Propiedades de los Aldehídos
Nomenclatura y Ejemplos
Para aldehídos:
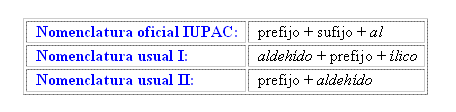
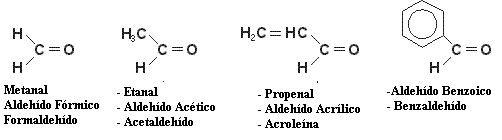
Algunos Ejemplos pueden ser:
Propiedades Físicas
A temperatura de 25ºC, los aldehídos con uno o dos carbonos son gaseosos, de 3 a 11 carbonos son líquidos y los demás son sólidos. Los aldehídos más simples son bastante solubles en agua y en algunos solventes apolares.
Presentan también olores penetrantes y generalmente desagradables. Con el aumento de la masa molecular esos olores van volviéndose menos fuertes hasta volverse agradables en los términos que contienen de 8 a 14 carbonos. Algunos de ellos encuentran inclusive su uso en perfumería (especialmente los aromáticos).
El grupo carboxilo confiere una considerable polaridad a los aldehídos y por esto poseen puntos de ebullición más altos que otros compuestos de peso molecular comparable.
Mientras tanto, no se forman enlaces de hidrógeno intermoleculares, visto que ellos contienen apenas hidrógeno enlazado al carbono. Comparándose las cetonas con los aldehídos isómeros, las cetonas tienen punto de ebullición más elevado y son más solubles en agua, pues sus moléculas son más polares que las de los aldehídos.
Propiedades químicas
Los aldehídos y cetonas son bastante reactivos en ocurrencia de gran polarizad generada por el grupo carboxilo, que sirve como lugar de adición nucleofílica y aumentando la acidicidad de los átomos de hidrógeno ligados al carbono α (carbono enlazado directamente al carboxilo). En relación a las cetonas, los aldehídos son bastante más reactivos. Cmo el grupo carbonilo confiere a la molécula una estructura plana y la adición de un reactivo nucleofílico puede ocurrir en dos lugares, osea, la superficie de contacto es mayor, lo que facilita la reacción.
Esto posibilita la formación de racematos (mezcla de enantiómeros), en caso que el carbono sea asimétrico.
Otros factores influencian la reactividad de los aldehídos y cetonas y son las intensidad de la polaridad entre C y O y el volumen de el/los agrupamiento/s enlazado/s al carboxilo.
Los grupos de inducción +I disminuyen la deficiencia electrónica en el carbono y consecuentemente disminuye la afinidad de este por reactivos nucleofílicos (:Nu), o sea la reacción de adición nucleofílica es mas difícil.
Ya los grupos de inducción –I aumentan la deficiencia electrónica en el carbono y consecuentemente aumentan la afinidad de este por reactivos nucleofílicos, o sea, la reacción de adición nucleofílica es más fácil.
En cuanto al volumen de el/los agrupamiento/s enlazado/s el carboxilo, tanto más facilitado será la reacción cuanto menor fuesen esos grupos, debido a un menor impedimento esteárico (facilita la aproximación del reactivo nucleofílico al carbono).
También la velocidad de la reacción crece proporcionalmente a la intensidad de la polaridad del grupo carboxilo, pues más intensa será la carga parcial positiva sobre el carbono, el mayor será su afinidad como el nucleofílico.
