Ósmosis
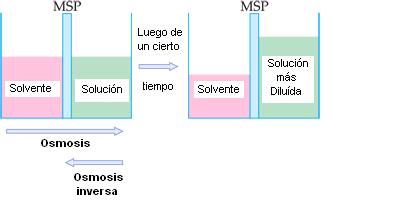
Osmosis es el pasaje de un solvente para el interior de una solución hecha de ese mismo solvente, a través de una membrana semipermeable (MSP). La osmosis también es una propiedad coligativa de la solución, pues depende del número de partículas disueltas.
Nota:
La membrana semipermeable (MSP), que puede ser hecha de vejiga de animal o celofán, es selectiva, o sea, deja pasar el solvente, pero no deja pasar el soluto.
Se observa que el nivel del solvente disminuye después de algún tiempo, mientras el nivel de la solución aumenta.
Ejemplo:
Dadas dos soluciones, A y B, inicialmente 0,1 M e 0,2 M, separadas por una membrana semipermeable.
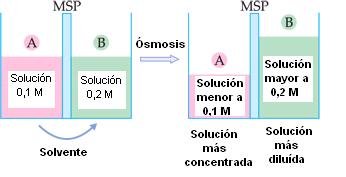
Se verifica que las soluciones A y B cambian de concentración después de la osmosis.
Presión Osmótica (Osmoscopía)
Presión osmótica es la presión que se debería aplicar sobre la solución para impedir el pasaje del solvente a través de la membrana semipermeable. La presión osmótica es representada por la letra griega p. Esa presión es equivalente a la presión ejercida por el solvente en el pasaje a través de la membrana.
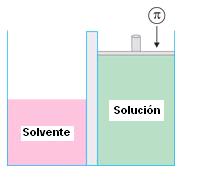
Osmoscopía es la medida de la presión osmótica, que puede ser medida por aparatos llamados osmómetros.
Soluciones isotónicas son soluciones de misma presión osmótica. Una solución será hipotónica en relación a la otra, cuando tenga menor presión osmótica; y será hipertónica cuando tenga mayor presión osmótica.
Ejemplo:
Una solución 0,4 molar de un cierto soluto será hipertónica en relación a una solución 0,1 molar del mismo soluto, en el mismo solvente y a la misma temperatura.
Leyes de Van’t Hoff para la Osmosis
1a) La presión osmótica es directamente proporcional a la temperatura absoluta de la solución:
![]()
2a) La presión osmótica es directamente proporcional a la concentración molar de la solución:
![]()
Juntándose las dos leyes por la proporcionalidad mutua, se obtiene:
![]()
Sabiéndose que
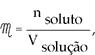
luego la ecuación (I) queda:
![]()
Donde:
k – constante universal de los gases perfectos (R);
![]()
p = Presión osmótica de la solución (atm o mmHg);
V = Volumen de la solución (litros);
n = Cuantidad e moles del soluto;
T = Temperatura absoluta de la solución (kelvin).
¿Quién congela primero: agua caliente o agua fría?

Se trata de lo siguiente: se coloca en el congelador dos vasos iguales llenos de agua, uno a temperatura ambiente (30°C) y otro salido de la caldera (70°C), ¿cuál congelará primero? Sorprendentemente, el agua que inicia más caliente congela primero
En verdad el agua caliente no congela más rápidamente que el agua fría, es claro. Pero se usted hierve agua y después la deja que se enfríe hasta que llegue a temperatura ambiente, ella congelará más rápidamente que otra cantidad de agua que no haya sido calentada antes. ¿Raro?
No, y vamos a ver el porqué. Cuando usted calienta el agua, ella pierde parte del aire disuelto en ella, que sale en forma de burbujas, ese aire es un mal conductor térmico. Así, el aire presente en el agua dificulta los intercambios de calor con el medio y dificulta la pérdida de calor que el agua necesita sufrir para que suceda el congelamiento.
Por esa misma razón, el hielo formado por agua previamente hervida tiene densidad mayor que aquél que se obtiene con agua que no pasó por ese proceso. En países muy fríos los caños del agua caliente tienden a reventar antes que los de agua fría, pues se congelan primero.
