Presión Osmótica
Osmosis es el pasaje del solvente de una solución ya diluida para otra con mayor concentración, a través de una membrana semipermeable.
La difusión del líquido para el otro medio de membranas fue observada por primera vez en 1758 por el padre francés Jean Antoine Nollet.

La ósmosis es realizada con el auxilio de una membrana semipermeable que permite el pasaje del solvente y no permite el pasaje del soluto. Existen muchos tipos de esas membranas. Como ejemplo, podemos citar el papel celofán, la vejiga animal, pared de las células, porcelana, zanahoria hueca, etc.
Ósmosis es el pasaje del solvente (agua pura) por la membrana semipermeable (MSP). El pasaje se da, desde la solución más diluida hacia la más concentrada.
El flujo de agua es más intenso en el sentido de la solución. Cuando los flujos se igualan, no existirán alteraciones en los niveles de los líquidos.
Si quisiéramos interrumpir la ósmosis, basta ejercer sobre el sistema formado por dos soluciones o una solución y un solvente, separados por una membrana semipermeable, una presión en el sentido inverso al de la ósmosis o como mínimo como la misma intensidad de aquel que el solvente realiza para atravesar la membrana semipermeable.
A esa presión, capaz de impedir el fenómeno de la ósmosis, damos el nombre de presión osmótica.
O sea, es definida como el equivalente a la presión que es necesaria aplicar sobre un recipiente conteniendo solvente puro de modo de impedir el ósmosis.
La presión osmótica de una solución
La presión osmótica es la presión que debe ser ejercida sobre la solución para evitar la entrada del solvente. Cuanto mayor la presión osmótica, mayor será la tendencia del solvente para entrar en la solución.
La presión osmótica puede ser medida aplicándose una presión externa que bloquee la ósmosis.
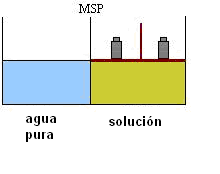
Observemos que la ósmosis fue bloqueada debido a la presión ejercida (peso) sobre la solución.
Ecuación de presión osmótica (π)
La presión osmótica (propiedad coligativa) depende de la concentración en mol/L del número total de partículas dispersas del soluto (M) y de la temperatura en kelvin de la solución (T).
π = M R T
En que R es la constante universal de los gases ideales (o sea que su valor es conocido)
Calculo del M
Soluto que no se disocia
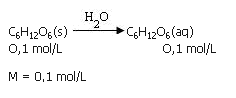
Soluto que se disocia (ácido, base, sal)
La disociación total (100/) del cloruro de sodio (NaCl)
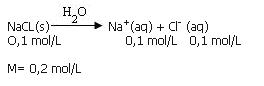
Flujo del Solvente
Observemos la demostración
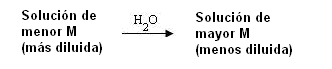
El flujo será de la solución de menor concentración (M) para la solución con concentración mayor.
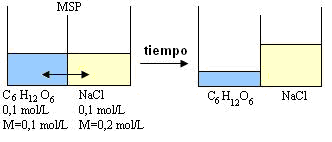
Reparemos que con el pasar del tiempo, la solución de NaCl aumentó, lo que quiere decir que la presión osmótica de esa solución es mayor.
Ósmosis natural: La salida del medio menos concentrado para el medio más concentrado.
Ósmosis inversa: La salida del medio más concentrado para el medio menos concentrado. Siendo:
π = Presión osmótica de la solución
M = Concentración del soluto en solución, expresado en moles/L (molaridad)
R = Constante universal de los gases perfectos cuyos valores son 0,082 atm.L.K-1.mol-1 ó 62,3 mmHg.L.K-1.mol-1 ou 8,31 J/mol.K
T = Temperatura en grados Kelvin
i = Factor de corrección de Van’t Hoff
Características Coligativas
La ecuación muestra que la presión de ebullición, a una temperatura dada y presión es una propiedad coligativa, pues depende solamente del número de partículas de soluto por unidad de volumen de la solución.
Observación:
Solutos moleculares como la glucosa y sacarosa, de igual concentración en mol/L, presentan la misma presión osmótica.
Solutos iónicos como el NaCl ó el CaCl2, más allá que tengan la misma concentración en mol/L, presenta presión osmótica diferente, debido al número de partículas producidas.
