Polaridad de los Enlaces Covalentes
Hasta el momento, los enlaces covalentes fueron definidos en el ambito de cómo dos núcleos comparten sus electrones, sin tomar en cuenta la naturaleza de ellos. Existen sin embargo, diferencias destacables en esa relación.
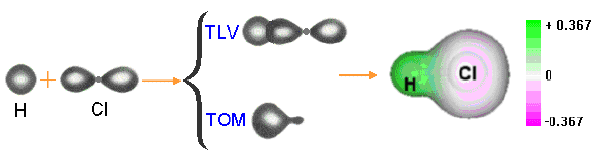
Si fuese considerada la molécula de H, donde dos átomos de hidrógeno comparten un par de electrones, se tiene a este par siendo atraído con la misma intensidad por los dos núcleos. Lo mismo sucede con la molécula del Cloro.
Por otra parte, cuando átomos diferentes están enlazados, no siempre este enlace será realizado en forma simétrica. Por ejemplo podemos considerar la molécula del Ácido Clorhídrico, en su molécula tenemos un átomo de Hidrógeno, enlazado a uno de Cloro, siendo el par de electrones atraído por ambos núcleos; la gran diferencia en la electronegatividad de estos átomos resulta en una mayor atracción del par de electrones por el núcleo del cloro.
De esta manera, la nube electrónica que forma el enlace estará distorsionada generando una falta de electrones (o carga parcial positiva) en torno al hidrógeno y un exceso de ellos (o carga parcial negativa) en torno al cloro.
Se puede entonces clasificar los enlaces covalentes en dos tipos: aquellos donde la nube electrónica no está polarizada, formada con átomos de electronegatividad semejante y aquellas donde ella se encuentra polarizada, en el caso de los núcleos con electronegatividad marcadamente diferentes.
Estos dos tipos de enlace covalente son conocidos como enlace covalente polar y no polar.
Como resultado de la polarización de enlaces covalentes, se tiene la formación de dipolos eléctricos. En el caso mencionado del ácido clorhídrico se puede presentar la formación de este dipolo eléctrico conforme a la figura que sigue:
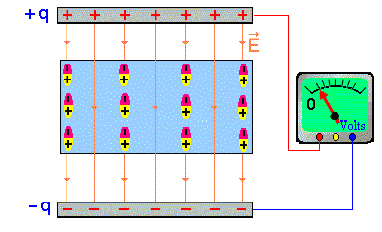
La formación de dipolos eléctricos en moléculas, como el caso del HCl, puede fácilmente ser verificado experimentalmente. Al aplicar un campo eléctrico, las moléculas van a girar de forma de alinearse con este campo, conforme lo mostraremos en el siguiente esquema:
 HCl
HCl
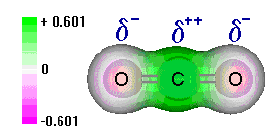
Consideremos por ejemplo, la molécula de CO2. En este compuesto, el carbono presenta dos enlaces con cada oxígeno, uno a través de un orbital híbrido tipo sp y el otro con un orbital p puro. De esta manera, la geometría de la molécula es lineal, con ángulo de 180º entre los dobles enlaces. Dada la mayor electronegatividad del oxígeno en relación al carbono, serán formados en esta estructura dos dipolos eléctricos conforme el esquema a continuación. Si los vectores que representan estos dipolos fuesen sumados, se vera que la resultante es nula. En otras palabras, la molécula de CO2, aún siendo formada por enlaces polares, será no polar.
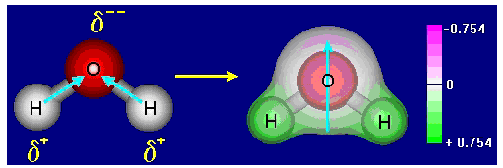
En la molécula de agua, H2O, el átomo de oxígeno posee una hibridación del tipo sp3, donde dos orbitales híbridos están con un par de electrones y los otros dos forman enlaces con átomos de hidrógeno. La geometría de la molécula es entonces triangular planar, con un ángulo de 104,5º. Dos dipolos son entonces formados debido a la gran diferencia de electronegatividad entre estos dos átomos. La sumatoria de estos dipolos no es nula, lo que significa que la molécula de agua presenta una polaridad resultante, conforme puede ser visualizado en el esquema a continuación:
La sumatoria de los momentos de dipolo son realizadas utilizando vectores. Para tal tarea, debemos transportar todos los vectores que representan los dipolos eléctricos existentes en la molécula, manteniéndose la inclinación original, de tal forma que el inicio de una coincida con el final de la otra.
El vector resultante que representa la polarización resultante en la molécula, es entonces obtenido uniéndose el inicio del primer vector de la suma con el final del último.
Fuerzas de Interacción Intermoleculares
La formación de dipolos eléctricos en moléculas covalentes, tiene como consecuencia el surgimiento de fuerzas electroestáticas entre ellas. O sea, los dipolos eléctricos se atraerán mutuamente, manteniendo las moléculas unidas. Además de este tipo de interacción considerada débil cuando es comparada con un enlace covalente, existen muchas otras fuerzas entre los compuestos químicos, las cuales son responsables por la existencia de los estados condensados de la materia (sólido y líquido). Entre las fuerzas de interacción intermolecular se pueden identificar dos tipos básicos: las de Van der Walls y el Enlace de Hidrógeno.
Fuerzas de Van der Walls
Las fuerzas de Van der Walls actúan entre iones, moléculas y átomos, siendo los principales tipos conocidos como fuerzas ión-dipolo, dipolo-dipolo, dipolo inducido y de London. Es extremadamente complejo explicar por medio de la matemática, via mecánica cuántica, estas interacciones. Sin embargo, podemos describirlas de forma cualitativa considerándolas como fuerzas de atracción electroestática, como será hecho a continuación:
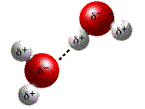
a) Fuerzas ión-dipolo: cuando un dipolo eléctrico, por ejemplo, la molécula del agua, sufre influencia del campo eléctrico generado por un ión que puede ser el catión de sodio, el se alineará al campo y se mantendrá unido a la fuente generadora. O sea, en este caso el oxígeno del agua donde esta localizada a carga parcial negativa, se une al catión de socio y los hidrógenos se alejan el máximo posible, conforme la figura a seguir.
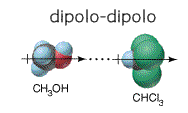
b) Fuerzas dipolo-dipolo: cuando dos moléculas polares, como el metanol y el cloroformo se aproximan, surgen fuerzas de atracción electroestática entre ellas- Es importante notar que estas fuerzas son direccionales, orientando los dipolos espacialmente, como lo mostraremos en la figura a continuación.
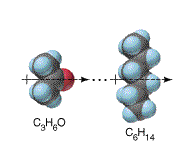
c) Fuerzas dipolares inducidas: cuando una molécula no polar se aproxima de otra polar, ocurre una distorsión de su nube electrónica generando un dipolo electrico. Entre este dipolo formado, conocido como dipolo inducido, y el inductor, ocurre entonces el surgimiento de fuerzas de atracción semejantes a las verificadas entre las moléculas polares. En la figura a continuación este proceso de inducción se esquematiza para su mejor comprensión.
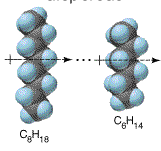
d) Fuerzas de London: este tipo de interacción surge entre las moléculas no polares. Se admite que la interacción originada por la aproximación de estas especies lleva a la formación de dipolos inducidos, los cuales se atraerán mutuamente. Este tipo de fuerza también es conocida como dispersión:
Enlace de Hidrógeno
Los enlaces de hidrógeno (o puente de hidrógeno) son difíciles de ser definidos, a la vez que son bastante más fuertes que las fuerzas de Van der Walls, sin embargo mas débiles que un enlace de valencia. Podemos decir que, cuando ligado a un grupo fuertemente electronegativo (A), como los átomos de Flúor, Oxígeno y Nitrógeno, el Hidrógeno puede presentar un segundo enlace, mas débil que el anterior con un segundo átomo (B).
Este segundo enlace es llamado entonces de enlace de hidrógeno, o puente de hidrógeno y es representada con un trazo discontinuo, como a continuación:
A-H …….B
Son conocidos los enlaces de hidrógeno formados con átomos pertenecientes a otra molécula, como las verificadas en el agua pura o en la solución de metanol en agua, como les mostramos a continuación:
Puentes de Hidrógeno entre las moléculas de agua
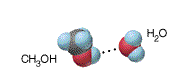
Puente de Hidrógeno entre moléculas de Metanol y Agua
