Ciclo de Born-Haber
En 1917, Born y Haber propusieron un ciclo termodinámico para el cálculo de la energía del retículo de sustancias iónicas ((ΔEret). El cálculo se realiza según la Ley de Hess. En este ciclo, es tomada en consideración la reacción heterogénea para la síntesis de la sal.
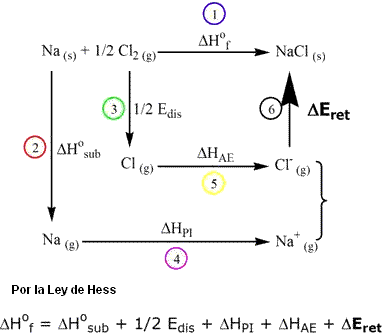
A) Para compuestos del tipo MX (por ejemplo: NaCl, KBr, CsI etc.):
b) Para compuestos del tipo MX2 (por ejemplo CaF2, MgBr2 etc.):
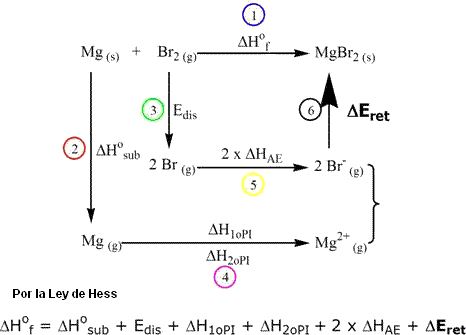
Con excepción del ΔEret, todos los otros valores son tabulados o pueden ser obtenidos experimentalmente. Las entalpías mostradas indican:
- ΔHof = entalpía padrón de formación del sólido iónico. La entalpía padrón de formación de una sustancia es el calor (a presión constante) liberado o consumido en la formación de 1 mol de la sustancia a partir de sustancias simples en estado padrón (estado físico y alotrópico más estable a 298 K y 1 atm). Por convención las sustancias elementales tienen entalpía padrón igual a cero.
- ΔHosub = entalpía de sublimación (o vaporización) del metal.
- Edis = energía de disociación – energía necesaria para disociar (X2 → 2X) 1 mol de moléculas de gas. También llamada energía de atomización.
- ΔHPI = potencial de ionización.
- ΔHAE = variación de entalpía asociada al proceso de afinidad electrónica (A.E.) (energía de electroafinidad)
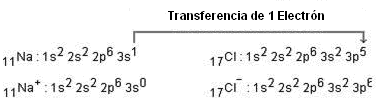
Para que exista formación de cloruro de sodio, debe ocurrir transferencia de electrones (reacción redox). El ciclo de Born-Haber intenta mostrar la energía de las etapas involucradas en la reacción entre las sustancias en sus formas elementales. En el caso específico del cloruro de sodio, la transferencia de electrones se da del solido para el cloro.
Las etapas indicadas en el ciclo de Born-Haber para el NaCl son las siguientes:
- Reacción heterogénea de formación de la sal a partir de las sustancias simples. Na (s) + ½ Cl2 (g) → NaCl (s) (ΔHof = -411,1 kJ/mol).
- Vaporización (sublimación) del sólido metálico, que es sólido a temperatura ambiente. Na (s) → Na (g) (ΔHosub = +107,8 kJ/mol).
- Disociación (quiebre homogéneo) de la molécula biatómica de Cl2, generando átomos de cloro. Cl-Cl (g) → 2 Cl (g) (Edis = +121 kJ/mol). Entonces, 1/2 Edis = 119,9 kj/mol.
- Ionización del sodio en fase gaseosa. Na (g) → Na+ (g) + 1e (ΔHPI = +495,4 kJ/mol).
- Formación de Cl– en fase gaseosa. Afinidad electrónica y la energía liberada por la adición de un electrón a un átomo en estado gaseoso. Cl (g) + 1e → Cl– (g) (ΔHAE = -348,8 kJ/mol).
- Formación de los pares iónicos en fase gaseosa [Na+Cl–], en virtud de la atracción electroestática. El balanceo entre la atracción y la repulsión electroestática provoca el establecimiento de una distancia interiónica de equilibrio volviendo el sistema más estable que los iones aislados. Estos pares están en forma gaseosa, pero, bajo la atracción electroestática que es ejercida sobre todos los iones, el conjunto de pares va aumentando. De esa forma comienza a ocurrir la reunión y superposición de los pares, hasta que sea formado un único grupo que constituirá un sólido cristalino macroscópico tridimensional, de geometría definida y estable. La estabilidad es alcanzada debido al abatimiento de energía del sistema ligado, provocado por la liberación de energía: la energía reticular (ΔEret). Así ΔEret puede ser considerada una medida de la energía (o fuerza) de enlace iónico. Luego, cuanto menor el valor de ΔEret, mayor es la energía liberada en esta etapa, más estable es el retículo cristalino. En el caso del NaCl, usando la Ley de Hess, tenemos ΔEret = -785,4 kj/mol. La formación de otros compuesto iónicos ocurre de manera análoga a aquella propuesta para el NaCl, respetando es claro, las peculiaridades de cada ciclo y la estequiometría de las sales.
La energía potencial total es la suma de todas las energías involucradas en las etapas. Por tanto, la energía reticular expresa la fuerza con que están unidas las partículas de un sólido cristalino y depende de la intensidad de la fuerza de interacción entre los iones y la geometría del retículo. Cuanto menor la distancia interiónica catión-anión, mayor la atracción entre las cargas opuestas.
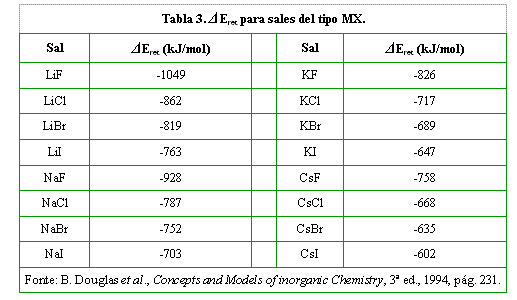
Veamos la siguiente tabla, con algunos valores para ΔEret.
En suma:
- La formación de iones gaseosos a partir de sustancias simples implica un aumento resultante en la energía potencial:
- La condensación de los iones para formar un sólido iónico lleva a una disminución en la energía potencial correspondiente a la energía del retículo:
- Cuanto menor la distancia interiónica catión-anión, mayor la atracción:
- Consecuentemente, menor (o mayor en módulo) es el valor de ΔEret. Así, mayor es la estabilidad del retículo cristalino.
La posibilidad de formación del compuesto iónico a partir de sus elementos ocurre cuando la disminución de energía potencial fuese mayor que el aumento. En otras palabras, la sal solo cristalizará si existe liberación de energía en su formación. Siendo así, la energía de red exotérmica precisa ser mayor que la combinación endotérmica de los factores involucrados en la formación de los iones en fase gaseosa. En caso contrario, el compuesto iónico no se forma, o forma una red cristalina inestable
