Electrodo ion selectivo
Básicamente existen dos tipos de conducción eléctrica: conductividad en metales, en los cuales la electricidad es transportada por electrones, y conductividad en líquidos con iones disueltos (electrolitos), en donde la electricidad es transportada por los iones.
En cualquier proceso electroquímico (celda galvánica, celda electrolítica, etc), podemos observar ambos tipos de transporte eléctrico. El lugar en donde el metal y el electrolito interactúan para transferir la carga eléctrica de uno a otro, es llama interface metal-líquido. Este tipo de interface es la que sucede en los electrodos.
Por ejemplo, en una celda galvánica cobre-plata, en uno de los electrodos ocurre un proceso de oxidación: el electrodo de cobre se oxida, liberando dos electrones y formando iones cobre, mientras que en el otro electrodo, sucede un proceso de reducción, los iones plata disueltos toman esos electrones, se reducen y se depositan átomos de plata metálica sobre el electrodo.
Los electrodos ion selectivos, son electrodos que se utilizan para medir la concentración de determinado ion en un electrolito. Para hacerlo, mide la diferencia de potencial causada por el contacto del electrodo con el ion en cuestión, respecto de la diferencia de potencial en el electrodo de referencia.
Estos electrodos ion selectivos poseen una membrana ion selectiva, que sólo responde al contacto con un determinado ion disuelto en la solución, y la diferencia de potencial generada a cada lado de la membrana se utiliza para medir la concentración del ion en la solución estudiada.
El electrodo ion selectivo debe estar inmerso en la solución acuosa que contiene el ion que se desea medir, y en la misma solución estará también inmerso el electrodo de referencia. Para completar el circuito electroquímico, ambos electrodos se conectan a un mini voltímetro, muy sensible, usando cables especiales de baja interferencia. Cuando el ion a medir atraviesa la membrana ion selectiva del electrodo, debido al gradiente de concentración, genera una diferencia de potencial que es medida. A mayor diferencia de potencial generada, mayor es la concentración del ion en la solución.
En la figura de abajo observamos un esquema del circuito que acabamos de describir.
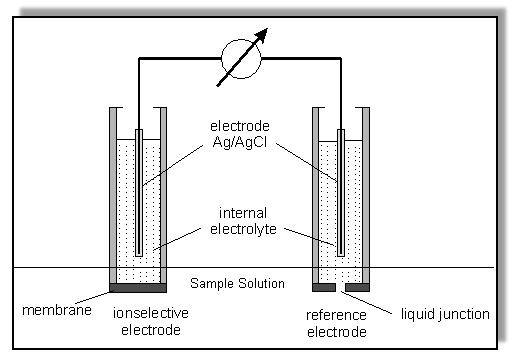
El electrolito en el cual está inmerso el electrodo ion selectivo, tiene una concentración conocida del ion que se pretende medir. En la membrana selectiva, que está en contacto con ion a medir disuelto la solución problema y con el electrolito de “referencia”, se genera una diferencia de potencial, que tiene relación directa con la concentración de dicho ion en la solución medida, de acuerdo con la ecuación de Nernst.
Una de las aplicaciones de esta técnica de potenciometría directa, es en el área de química clínica, en donde se logra medir la concentración de iones y gases en sangre de pacientes, gracias a aparatos en los cuales están instalados varios electrodos ion selectivo, uno para cada parámetro que se desea medir. Los iones más frecuentemente medidos en el ionograma sérico, son sodio, potasio, calcio y cloro, ya que son los más importantes en el equilibrio electrolítico del organismo.
