Electrodo de referencia
Cuando un electrodo se coloca en contacto con un electrolito, se crea entre ambos una diferencia de potencial. Esta diferencia no puede ser medida de manera absoluta, por lo tanto se mide en comparación con un electrodo especial, un electrodo patrón, que es el electrodo de referencia.
Este electrodo está formado por una lámina de platino platinada, en contacto con hidrógeno gaseoso a una atmósfera de presión. El electrodo se encuentra sumergido en un electrolito con iones hidrógeno disueltos (solución ácida). La actividad entre estos iones y el electrodo, a 25°C, se toma como cero de la escala. La reacción que ocurre entre el electrodo de referencia y el electrolito en el cual está sumergido es el siguiente equilibrio:
![]()
En las condiciones arriba mencionadas, la diferencia de potencial que se genera en el electrodo de referencia depende exclusivamente del pH del electrolito con el cual está en contacto, de acuerdo con la siguiente fórmula:
![]()
Pero trabajar con un electrodo de hidrógeno representa inconvenientes varios, dado que es muy frágil y se dificultaría su uso en la práctica, por lo tanto se utilizan otros electrodos de referencia, que cumplen con ciertas condiciones particulares. Además de ser sencillos u manejables, la principal condición que deben cumplir es el potencial de equilibrio en la reacción redox que se da en ellos, sea constante y tenga relación con el potencial en el electrodo de hidrógeno.
Dentro de los electrodos de referencia más usados, tenemos.
Electrodo de calomelanos. Consiste en mercurio recubierto con una capa de Hg2Cl2, que se encuentra sumergido en una solución de cloruro de potasio (KCl), cuya concentración puede ser 0,1 N, 1 N o saturada. El contacto entre el mercurio y la solución se establece mediante un hilo de platino. En la figura de abajo observamos un esquema de dicho electrodo.
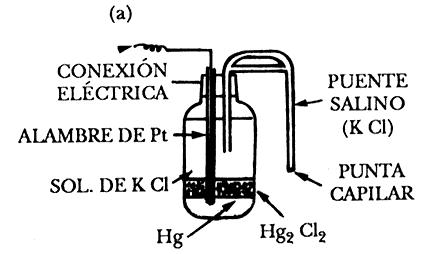
La reacción de óxido reducción en equilibrio que sucede en este tipo de electrodo se puede describir de la siguiente manera:
![]()
Electrodo de plata y cloruro de plata. Consta de un hilo de plata sobre el cual se depositará cloruro de plata, mediante una reacción electroquímica, en una solución de cloruro de potasio o cloruro de sodio.
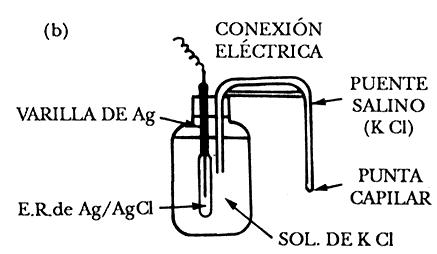
La reacción en el electrodo sería la siguiente:
![]()
Electrodo de zinc. Está formado por una pieza de zinc de alto grado de pureza. La reacción en este tipo de electrodo sería la siguiente:
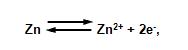
En la figura de abajo observamos un esquema de un electrodo de referencia a base de zinc.

Electrodo de cobre y sulfato de cobre. Una barra de cobre, de forma cilíndrica, se sumerge en una solución de sulfato de cobre, saturada. El esquema de este tipo de electrodo sería:
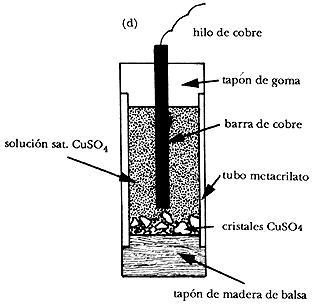
La reacción que sucede en este tipo de electrodo de referencia es la siguiente:
![]()
Una de las ventajas de este electrodo es que puede utilizarse en variados ambientes, como agua de mar, aguas saladas o dulces, o suelos. Es un electrodo sencillo, de fácil construcción y de gran estabilidad.
