Potencial de unión líquida
Se le llama potencial de unión líquida a la diferencia de potencial observada en la interfase de dos disoluciones de distinta concentración, que se hallan en contacto a través de una membrana, por ejemplo. Esta diferencia de potencial de debe a que los iones de la disolución más concentrada tienden a difundir hacia la disolución más diluída, a distintas velocidades, generando una doble capa de iones con distinta carga, formándose una diferencia de potencial entre ambas.
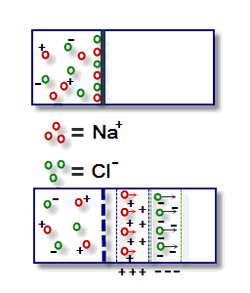
En la figura de arriba podemos observar una solución de cloruro de sodio difundiendo a través de una membrana; los aniones cloruro (Cl–) migran a una velocidad mayor que los cationes sodio (Na+). Así se forma la doble capa que general el potencial de unión líquida, también llamado potencial de difusión. Este potencial muchas veces es pequeño, apenas algunos milivoltios, pero es imposible de medir experimentalmente, solo se lo puede calcular.
El potencial de la membrana celular es un ejemplo biológico de potencial de unión líquida. Los iones difunden a través de la membrana celular semipermeable y son responsables de la transmisión del impulso nervioso, entre otros fenómenos.
Movilidad de algunos iones a temperatura ambiente (25 ºC):
| NH4+ 7,61·10-8 | (m2/(s·V) | OH– | 20,50·10-8 | (m2/(s·V) |
| Na+ 5,19·10-8 | (m2/(s·V) | Cl– | 7,91·10-8 | (m2/(s·V) |
| K+ 7,62·10-8 | (m2/(s·V) | NO3– | 7,40·10-8 | (m2/(s·V) |
| H+ 36,30·10-8 | (m2/(s·V) | HCO3– | 4,61·10-8 | (m2/(s·V) |
A continuación, algunos potenciales de unión líquida, (25 ºC)
| Disolución A | Disolución B | Potencial de unión (mV) |
| NaCl 0,1 M | KCl 3,5 M | -0,2 |
| NaCl 0,1 M | KCl 0,1 M | -6,4 |
| NaCl 1,0 M | KCl 3,5 M | -1,9 |
| HCl 0,1 M | KCl 0,1 M | +27,0 |
| HCl 0,1 M | KCl 3,5 M | +3,1 |
El potencial de unión líquida es un impedimento para realizar con exactitud una medida potenciométrica directa, dado que entre el electrodo de referencia y la disolución que lo rodea se da el fenómeno de potencial de difusión, y es difícil conocer la magnitud de su influencia en la diferencia de potencial que se pretende medir.
El electrodo de referencia está formado por un conductor metálico que está en contacto con una solución de composición constante y elevada concentración, llamada electrolito de referencia. Este electrolito toma contacto con la disolución a medir a través del diafragma, que es una membrana porosa a través de la cual sucede la unión líquida. Los aniones y cationes del electrolito de referencia, cuya concentración es mayor qua la disolución a medir, tenderán a fluir hacia la misma. Si los iones migran a distintas velocidades, entonces aparecerá el potencial de unión líquida.
Este potencial depende del tipo, temperatura y concentración del electrolito de referencia. Para que este potencial de difusión sea lo mas constante y pequeño posible y de esta manera no interfiera en la medición, se deben elegir electrolitos de referencia cuyos iones tengan movilidades similares. La concentración de este electrolito debe ser elevada, 5 a 10 veces mayor que la esperada en la solución que se pretende medir. Otras medidas a tomar para minimizar éste potencial, serían elegir el diafragma adecuado, y mantener una velocidad de agitación constante.
