Vibraciones Moleculares
Las vibraciones moleculares son estudiadas a partir de la espectroscopía. Existen varios métodos de análisis espectroscópico, siendo que el más conocido es la espectroscopía por infrarrojo. El objetivo casi siempre es el mismo, descubrir las ‘‘firmas’’ o ‘‘huellas digitales’’ que cada substancia o molécula emite cuando interactúa con la luz.
Por medio de la espectroscopia es posible reconocer la presencia de una determinada molécula a trabes del pico de intensidad de su frecuencia de vibración, que depende de las masas y de las fuerzas que están interactuando entre los átomos de una molécula. Los movimientos vibratorios de las moléculas se pueden clasificar en tres tipos:
a) modo de extensión, que corresponde a la variación de la distancia entre los átomos;
b) modo de flexión, que corresponde a la variación del ángulo formado por dos enlaces sobre un mismo átomo y;
c) modo de torsión, que corresponde al giro relativo de dos grupos de átomos sobre un enlace
Como interactua la luz con las vibraciones moleculares
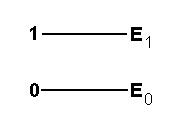
Vamos a utilizar el método usual de representar esquemáticamente las energías de los estados de vibración con un diagrama de niveles. Cada energía posible para la vibración de una molécula será representada por un guión ( __ ), ordenados según los valores crecientes de la energía, como vimos en el caso del electrón en el átomo de Bohr.
Para simplificar nuestra descripción, supondremos que cada modo normal de vibración sólo tiene dos estados (y niveles de energía) posibles. Lo más bajo corresponde simplemente a una molécula parada, sin vibrar, luego, con energía E0 = 0. Este es el llamado estado fundamental de la vibración molecular. El otro nivel corresponde a la energía E1 que la molécula tiene cuando esta vibrando en uno de sus modos normales. Por lo tanto, para persuadir una molécula que esta parada a vibrar con ese modo normal, es necesario aplicarle una energía E1. Esto significa ‘‘excitar’’ a la molécula, y ahí ese estado se llamara estado excitado.
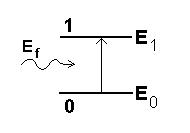
Un fotón incidiendo sobre la molécula puede hacer ese trabajo por usted. Basta que el tenga energía Ef igual a la diferencia de energía entre los niveles excitado y fundamental.
Esto es, Ef = E1
En este caso, el foton puede ser tragado por la molécula y desaparecer. Decimos que el foton fue absorbido. Las vibraciones moleculares acostumbran absorber fotones que pertenecen a la región Infra-roja del espectro.
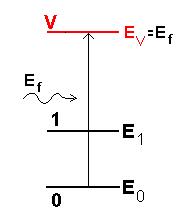
Ahora, veamos que sucede en la dispersión Raman. En este caso, el foton incidente tiene una energía Ef mucho mayor que la energía E1 del modo normal. Al incidir sobre la molécula, el fotón la puede excitar hasta un estado cuya energía EV es mucho mayor que la energía E1 del modo de vibración. En general, esta excitación es electrónica, del tipo de aquellas que encontramos en el caso del átomo de Bohr. Pero, estos estados excitados son muy inestables y la molécula rápidamente cae para estados de menor energía. La molécula puede, por ejemplo, volver al estado fundamental (0), volviendo a emitir un foton con la misma energía del foton incidente, en una dirección que puede ser diferente de la dirección que tenía antes. Para todos los efectos, el foton incidente fue simplemente dispersado, sin perder nada de su energía inicial. Esa es la dispersión Rayleigh, como ya vimos. La gran mayoría de los fotones que inciden sobre la molécula de esa forma.
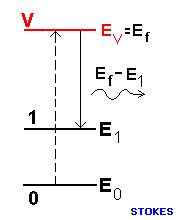
Sin embargo, en algunos casos, la molécula no vuelve al estado fundamental. Después de decaer, queda en el estado vibracional (1), con energía (E1). En este caso, el foton que es reemitido en cualquier dirección, tiene su energía disminuida hacia Ef – E1. La molécula y su vibración roban un poco de energía del foton. Este es un tipo de dispersión Raman.
Pero existe otra posibilidad. La molécula puede ya estar vibrando con energía E1, cuando el foton incide sobre ella, llevándola a una energía mucho más alta EV´. De ese estado V´ la molécula decae, pero ahora para el estado fundamental (0), En el proceso, un foton de energía Ef + E1 es emitido. Ahora, fue el foton quien robó un poco de energía de la molécula, por lo tanto el proceso Raman puede producir foton con energía mayor o menor que la energía del foton incidente.
Cuando la energía del foton disminuye generando una vibración de la molécula, el proceso es llamado de Stokes, por razones históricas. En otro caso, en el que la energía del foton aumenta robando energía de vibración de la molécula, el proceso es llamado anti Stokes.
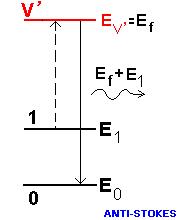
Quién hace que las moléculas vibren aún antes de recibir la luz, es la agitación térmica. El ambiente donde está la muestra cambio de calor (energía) con las moléculas, excitando algunas de ellas a sus modos normales de vibración. Son esas que pueden producir la dispersión Raman anti Stokes. Normalmente en una muestra la temperatura ambiente, el número de moléculas que están en estado municipal es mucho mayor que el de moléculas ya excitadas térmicamente. Por lo tanto el número de procesos del tipo Stokes es mayor que el número de procesos anti Stokes.
Más adelante vamos a ver que tipo de vibración puede generar una dispersión Raman y que tipo no puede hacerlo. Eso nos llevará hacia las intimidades de la interacción entre luz y materia.
