Termoquímica – Conceptos Generales
Las transformaciones sufridas por la materia son casi siempre acompañadas por absorción o liberación de energía. Esta energía es estudiada por una rama de la química denominado Termoquímica.
Las reacciones químicas en lo que se relaciona al calor involucrado pueden ser clasificadas en:
Endotérmicas:
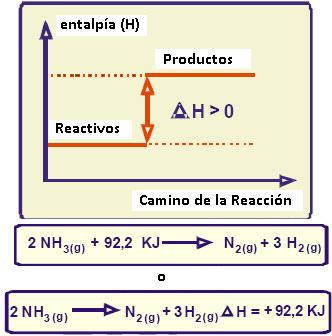
Son aquellas reacciones que suceden absorbiendo calor externo
Exotérmicas:
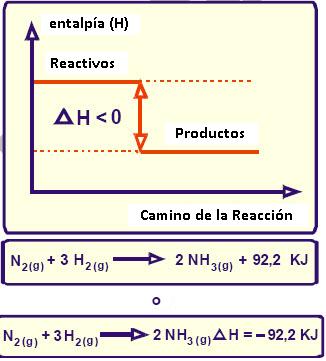
Son aquellas reacciones que suceden y libran calor al medio donde se producen
El calor es la forma más común de energía que acompaña una reacción química. La cantidad de calor puede ser calculada por la siguiente fórmula:
Donde Q es la cantidad de calor en Joules o Calorías liberada, m es la masa de la substancia que recibe o cede calor, c es el calor específico de la substancia que recibe o cede calor, Δt es la variación de temperatura sufrida por la substancia que recibe o cede calor en ºC.
Podemos utilizar también la caloría (cal) para medir la cantidad de calor involucrada en las reacciones
Como la cantidad de calor involucrada en una reacción química es en general grande, utilizamos el múltiplo de la caloría y del Joule que son respectivamente la quilo caloría (Kcal)y el quilo joule (KJ).
Cuando la madera sufre combustión por ejemplo, libera calor. De donde viene este calor? Toda especie química posee energía que cuando es medida a presión constante se denomina entalpía (H).
No se puede calcular la entalpía de un sistema, pero si su variación (ΔH).
En los procesos endotérmicos tenemos que ΔH > 0 y en los procesos endotérmicos ΔH < 0
Gráficamente podemos ver que en proceso exotérmico:
Mientras que en el proceso endotérmico gráficamente podemos ver:
Factores que afectan la entalpía de las reacciones
Cantidades de las especies químicas
La cantidad del valor involucrada en una reacción depende inicialmente de las cantidades de los reactivos y productos de la misma.
El valor de variación de entalpía escrito al lado de la ecuación química se refiere a las cantidades en moles escritas en la ecuación
En esta ecuación podemos ver que 2 moles de H2(g) reaccionan con 1 mol de O2(g) , produciendo 2 moles de H2O(l) con liberación de 572 kJ.
Dividiéndose todos los coeficientes por 2, la variación de entalpía también será dividida por 2.
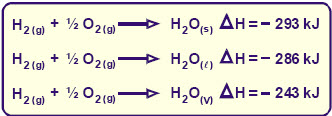
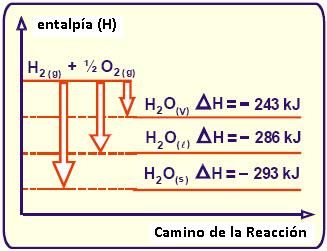
Estado Físico de los Reactivos y Productos
Y gráficamente tendremos que:
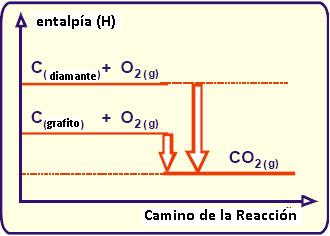
Estado Alotrópico
Esto ocurre porque el diamante posee mayor entalpía acumulada que el grafito.
Gráficamente tendremos que:
El estado alotrópico de la sustancia influye en la entalpía de la reacción. Se observa que la forma alotrópica de mayor entalpía es más relativa y la de menor entalpía es más estable.
Las formas alotrópicas de las sustancias más comunes son:
- Azufre: Romboidal (mas estable) y azufre monoclínico
- Fósforo Rojo (más estable) y fósforo blanco
- Oxígeno (más estable) y ozono
- Grafito (más estable) y diamante
Ecuación Termoquímica
La ecuación química que indica la variación de entalpía de la reacción, los estados físicos de las sustancias y las condiciones de temperatura y presión en que la misma se procesa, por ejemplo puede ser:
Observaciones:
- Si la ecuación termoquímica en un sentido es endotérmica, en el sentido contrario será exotérmica.
- Cuando no citamos los valores de presión y temperatura es porque corresponden a condiciones ambiente.