Conceptos de Electroquímica
Por el nombre ya podemos darnos cuenta de que vamos a estudiar las reacciones entre la electricidad y la química, esto es, vamos a estudiar, principalmente dos reacciones:
Pilas: Que son reacciones de oxi-reducción capaces de generar corriente eléctrica.
Electrólisis: Que son reacciones de oxi-reducción producidas por el pasaje de la corriente eléctrica.
Parte 1: Pilas
La primera pila data del año 1800 y fue creada por el italiano Alessandro Volta.
Para entender el funcionamiento de la pila podemos realizar el siguiente experimento: compra una solución de CuSO4 (sulfato de cobre), que se vende en ferreterías y un pedazo de hoga de Zn (zinc), obtenido también en tiendas de ferretería o en el cuerpo de una pila común que podemos tener en casa.
Coloquemos la barra de Zn en la solución de CuSO4 y observa durante aproximadamente 3 horas y entonces verás una coloración rojiza que se adhirió en la barra de zinc que hemos sumergido.
¿Y que sucedió aquí?
Sucedió un depósito de cobre en el zinc, según la reacción:
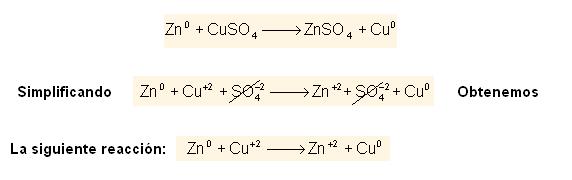
Conclusión: Ya sabemos que la transformación de un elemento químico neutro para un ión sucede porque el “da” electrones como en el ejemplo: el zinc pasó de Zn a Zn+2.
El se oxidó (recordemos: quien se oxida dá – oxiDA), pasando dos electrones para el cobre que estaba en la solución en la formación de ión Cu+2 y pasó a ser el metal Cu (Cu0).
Es interesante notar que esa reacción ocurrió de forma espontánea. Por ahora diremos que el Zn tiene mayor tendencia de “dar” electrones, en tanto que el cobre tiene mayor tendencia de “recibir” electrones. Queda evidente que esa tendencia de dar y recibir puede ocurrir con otros elementos dependiendo apenas de su potencial.
Por ejemplo: Si hacemos el mismo procedimiento con una chapa de cobre en una solución acuosa de sulfato de plata (Ag2SO4) ocurrirá que la plata (Ag) quede impregnada en la chapa de cobre y a continuación la siguiente reacción ya simplificada:
En tanto, si hacemos la experiencia al revés, sumergiendo una chapa de plata en una solución de CuSO4 (sulfato de cobre) nada sucede.
Conclusión Final: Esta última experiencia muestra que los átomos tienen tendencias para dar y recibir sus electrones, por lo menos espontáneamente. En relación a los tres elementos involucrados queda comprobado que el Zn “da más” que el Cu y este más que la Ag.
Esa tendencia se atribuye la configuración electrónica más estable, por eso los electrones prefieren quedarse más sobre la plata que sobre el cobre o el zinc.
Pila de Daniell
La Pila de Daniell nada más es que la experiencia realizada anteriormente con el zinc y cobre, solo que la transferencia de electrones ocurre a través de un cable externo.
Representação Esquemática
Por convenção ficou estabelecido o seguinte esquema para se representar pilhas:
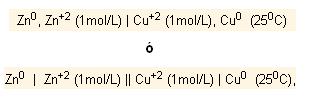
donde son provistos los electrodos, las molaridades de las soluciones y la temperatura de funcionamiento de la pila.
Vocabulario para el estudio de las pilas:
Electrodo: Barra metálica, pedazo de grafito e inclusive un pedazo de cable pelado.
Semicelda: conjunto formado por el electrodo y la solución iónica de la pila.
Ánodo: Semicela que emite electrones para el circuito externo. Es el polo negativo de la pila, donde ocurre el proceso de oxidación.
Cátodo: Semicelda que recibe electrones del circuito externo. Es el polo positivo de la pila, donde ocurre el proceso de reducción.
Celda Electroquímica: Conjunto completo que constituye una pila. Está formada por dos semiceldas.
