Ley de Hess
El químico suizo German Henry Hess (1802-1850) tuvo una gran contribución para la química, más específicamente para la Termoquímica, sus estudios abarcan la entalpía de reacciones químicas. Gracias a este científico es posible calcular la variación de entalpía, la Ley de Hess recibió este nombre en homenaje a su creador y tiene la siguiente definición:
Para una reacción dada, la variación de entalpía depende apenas del estado inicial de los reactivos y del estado final de los productos, este esa reacción ocurriendo en una o varias etapas.
Cuando la reacción química ocurre en uno o más de una etapa, la variación de energía térmica en ese proceso es constante, pues la variación de energía depende apenas de las propiedades de las sustancias en los estados inicial y final.
La ley de Hess es bastante utilizada para determinar indirectamente calor de reacción. Es importante destacar que esta ley es una manifestación de la ley de conservación de la energía, también conocida como la primera ley de la termodinámica. Esta ley establece que la energía no puede ser creada ni destruida, solo puede cambiar de forma. En el contexto de las reacciones químicas, esto significa que la cantidad total de energía en el universo permanece constante.
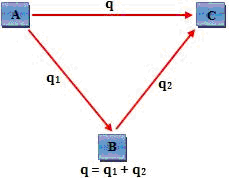
El total de calor liberado o absorbido en las reacciones sucesivas A — > B y B— > C es equivalente al calor liberado o absorbido en la reacción A — > C
Análogamente, podemos decir que:
“La variación de entalpía, o sea, cantidad de calor liberada o absorbida por un proceso solo depende del estado final del proceso no dependiendo de sus etapas intermedias”
A — > B — > D — > C – calor completo – q1
A — > B — > C – calor completo – q2
A — > C – calor completo – q3
q1 = q2 = q3
El calor liberado o absorbido en la reacción A — > C depende apenas del contenido energético de A y C.
Un ejemplo puede auxiliar al entendimiento de esta ley: Si hacemos un paseo y para llegar al destino tuviésemos a disposición dos caminos, uno más largo y uno más corto, ¿cual de ellos tomaríamos? Es claro que el más corto es el preferido, pero de cualquier forma el destino final será el mismo, o sea, el lugar de partida y de llegada no cambia, lo que cambia es el trayecto elegido.
La variación de entalpía en una reacción, también funciona así: ella depende apenas del estado inicial y final de los estados intermedios.
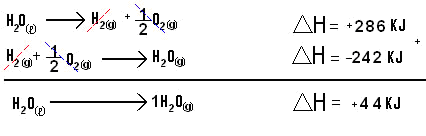
Ahora veamos la aplicación de la Ley de Hess en el pasaje del agua del estado líquido para el estado gaseoso. La variación de entalpía es representada por ∆H:
H20(l) — > H20(g) ∆H = + 44 KJ
Reparemos que en esta ecuación el pasaje de 1 mol de H20(l) para el estado gaseoso fue realizada en una única etapa, veamos ahora como obtener el mismo producto en dos etapas:
La ecuación global nos permite verificar que el ∆H (final) de una reacción puede ser obtenido por la suma algebraica de los ∆H de reacciones intermedias.
A través de las demostraciones presentadas, podemos concluir que la variación de entalpía (∆H) es la misma si la reacción es realizada en una o varias etapas, tal como lo especifica la Ley de Hess. Esta ley es una herramienta esencial en la química física y se utiliza ampliamente en la industria química y en la investigación científica. Su aplicación permite a los químicos predecir los resultados de las reacciones y diseñar procesos químicos más eficientes y seguros.