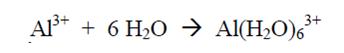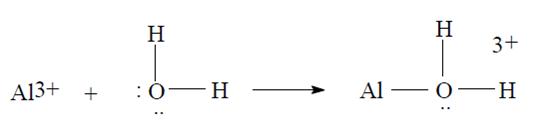Equilibrio de Complejos
Cuando un ion metálico o de cualquier sustancia se combina con un grupo donador de un par de electrones, el compuesto resultante se conoce como un compuesto complejo o la coordinación.
Complejo es el producto de una reacción entre un ácido de Lewis y una base de Lewis. Una base de Lewis tiene un par de electrones disponibles que se donan al ácido de Lewis y el par de electrones en el producto resultante, es compartida por ambas especies químicas.
Por ejemplo, la formación de un ión de aluminio hidratado cuando una sal de aluminio se disuelve en el agua es una reacción ácido-base de Lewis:
|
|
||
|
Ácido |
Base |
Complejo |
El enlace de una molécula de agua a los iones de aluminio se produce por la donación de un par de
los electrones del átomo de oxígeno a los iones de aluminio:
|
|
||
|
Ácido |
Base |
Complejo |
Las otras cinco moléculas de agua, se enlazan de forma semejante para formar el ión aluminio totalmente hidratado.
Siendo así, complejos consisten de un único átomo metálico central o ion (ácido de Lewis), al cual están enlazados varias moléculas o aniones (bases de Lewis).
La fórmula química de los complejos es tradicionalmente colocada entre corchetes rectos.
Ejemplos:
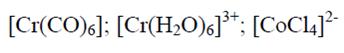
Los iones o moléculas enlazados al átomo metálico por coordinación son denominados “ligantes” y deben poseer par o pares de electrones no compartidos, para que establezcan los enlaces. Un ligante puede ser un simple anión, como por ejemplo Cl-, F-, o moléculas neutras tales como H2O, NH3, o especies cargadas tales como CN–.
En los complejos, los “ligantes” se enlazan al átomos metálico central apenas por un único punto, o sea, un único enlace para cada ligante-átomo central.
Cuando un catión metálico se enlaza a una sustancia que posee dos o más grupos de dadores de pares de electrones (agrupamientos conteniendo pares aislados de electrones), de forma que se forma una o más estructuras en anillo, el compuesto resultante es llamado “quelato” o “quelato del metal” y la sustancia dadora de electrones es denominada “agente quelante”.
Siendo así, algunos enlazantes pueden ser enlazados al átomo metálico central por más de un punto de enlace. Los complejos de este tipo son llamados quelatos y los ligantes “agentes quelantes” o “ligantes de quelación”