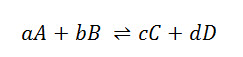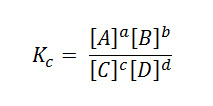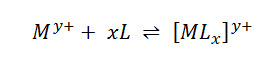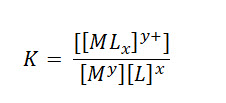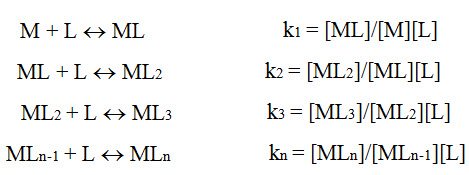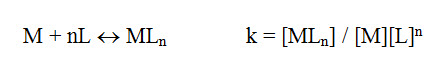Equilibrio de Complejos – Efecto de la concentración
La concentración de las sustancias altera el equilibrio de la siguiente forma: cuando se aumenta la concentración de uno de los productos, el equilibrio es desplazado en el sentido de la formación de los reactivos; cuando se aumenta la concentración de uno de los reactivos, el equilibrio se desplaza en el sentido de la formación de los productos.
Al disminuirse la concentración de uno de los reactivos, el equilibrio es desplazado hacia la formación de reactivos, cuando se disminuye la concentración de uno de los productos, el equilibrio es desplazado en el sentido de la formación de los productos.
Entonces se percibe que el equilibrio siempre es desplazado para que la falta o el exceso de uno de los componentes sean compensados. Este hecho se denomina ley de la acción de masas.
Como el equilibrio es siempre desplazado de forma de compensar la perturbación sufrida por el sistema, existe una relación que determina este desplazamiento, la llamada constante de equilibrio representada por Kc.
Esta constante de equilibrio está dada por la razón entre los productos de las concentraciones de los productos, por el producto de las concentraciones de los reactivos.
Como lo podemos ver en la siguiente reacción:
La constante Kc viene dada desde:
Así entonces, siendo que el equilibrio se altere, la constante tendrá siempre el mismo valor. La formación de un complejo puede también alterar el equilibrio de una reacción; pero, primeramente vamos a definir lo que es un complejo.
Complejos o compuestos de coordinación son productos de una relación entre un ácido de Lewis y una base de Lewis, definidos como “un compuesto que contiene un átomo o ion central, al cual están ligados moléculas neutras o iones, cuyo número generalmente excede el número de oxidación o valencia del átomo o ion central.
Generalmente, el átomo central es un metal en transición, formando complejos coloreados, pero también existen complejos en que el átomo central es un metal representativo y en este caso, los complejos son blancos, a no ser que el metal esté ligado a un ligante coloreado.
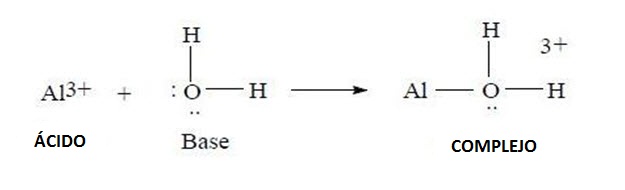
Un ejemplo de la formación de complejo y la reacción entre los iones Al3+, que funcionan como ácidos de Lewis y moléculas de agua que participan de la reacción actuando como una base de Lewis.
Formación de un complejo a partir de la reacción entre un ácido de Lewis y una base de Lewis.
Es así que seis moléculas de agua se acomodan en torno al ion trivalente del aluminio para formar el complejo [Al(H2O)6]3+.
Otros ejemplos de complejos bastante presentes en nuestro día a día son la hemoglobina, complejo de hierro, que da color rojo a la sangre y la clorofila complejo del magnesio que da el color verde a los vegetales.
En los casos de formación de complejos en solución acuosa, la constante no es llamada constante de equilibrio, sino que pasa a ser llamada constante de formación o constante de estabilidad, calculada por la misma relación descrita en la ley de acción e masas. Para la reacción de formación de un complejo descrita por:
Mientras que la constante de estabilidad viene dada por:
Esta constante puede ser alterada a medida que los ligantes (L) se van uniendo, sucesivamente al átomo central (M), en caso que la formación se de por etapas sucesivas.
Para los complejos de formación sucesiva, los valores de K1, K2, K3, Kn, son denominados constantes de formación parcial y el producto de estos valores se llama constante de formación total o absoluta. Entonces se pueden combinar las ecuaciones precedentes en apenas una:
La constante de formación entre la concentración del ion complejo del metal y las concentraciones de los iones metálicos y de los ligantes libres en la solución. Visto que cuanto mayor es la concentración del complejo y menor es el producto de las concentraciones del ion y de los ligantes libres, mayor es el valor de la constante y mayor es la estabilidad del complejo
Al contrario, si la concentración del complejo fuese muy pequeña y el producto de las concentraciones de los iones metálicos y de los ligantes libres tuviese un alto valor, menor será el valor de la constante de estabilidad y menor será la estabilidad del complejo formado.
Entonces cuanto mayor fuese el valor de la constante, mayor es la estabilidad del complejo formado.