Ebullición de un líquido puro
En el pasaje del estado físico «líquido» para el estado «vapor», ocurre el fenómeno denominado vaporización, puede ocurrir de dos maneras:
– por evaporación, donde el proceso es lento y se hace en la superficie del líquido.
– por ebullición que es una vaporización turbulenta, con la formación de burbujas en todo el interior del líquido.
Se dice que un líquido está en ebullición cuando la presión del vapor de las burbujas formadas en el proceso es igual o superiora la presión externa, o sea, en un recipiente abierto, la presión externa será la presión atmosférica y, cuando la presión de las burbujas formadas sea igual o superior a la atmosférica, ocurre el proceso de ebullición del líquido.
No es difícil ver que, en la medida en que la presión atmosférica va disminuyendo, más fácilmente será alcanzada la presión de vapor de la burbuja necesaria para la ebullición y menor será la temperatura de ebullición del líquido. En la tabla 1 podemos observar las temperaturas de ebullición del agua (escala ºC) inversamente proporcional a la altitud del lugar, siempre tomando como base el nivel del mar. Tenga en cuenta que cuanto mayor sea la altitud, menor la camada de aire y, en consecuencia, menor la presión atmosférica ejercida sobre el líquido, lo que implica en un proceso de ebullición a una temperatura inferior a la de un lugar con menor altitud.
| Localidad | Altitud en relación
al nivel del mar (m) |
Temperatura aproximada de ebullición del agua (ºC) |
| Rio de Janeiro | 0 | 100 |
| San Paulo | 750 | 97 |
| Ciudad de México | 2.240 | 92 |
| La Paz | 3.636 | 88 |
| Monte Kilimanjaro | 5.895 | 82 |
| Monte Everest | 8.848 | 70 |
Tabla 1 – Puntos de ebullición del agua en diversas regiones de la Tierra
Como vimos, a temperatura de ebullición está directamente asociada a una propiedad de las substancias llamadas presión de vapor. Aquí, tenemos las curvas de presión de vapor de tres substancias. Nos damos cuenta de varias asociaciones y que pueden resumirse en lo siguiente:
- Mayor presión de vapor
- Líquido más volátil
- Menor temperatura de ebullición
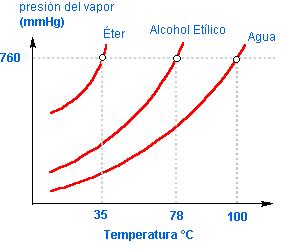
Figura 1 – Pontos de ebullición a una presión constante de diferentes substancias
Véase en la figura 1 que el compuesto más volátil es el éter, con una temperatura de ebullición de 35ºC, que es bastante inferior a la del agua. La explicación de eso nos reporta a un análisis de las interacciones moleculares del compuesto, con el fin de relacionar la polaridad con los enlaces intermoleculares. Para un análisis simplificado del caso, la relación entre las magnitudes de energía que participan en las fuerzas intermoleculares se muestra en la figura 2:

Figura 2 – Magnitud de las interacciones intermoleculares
Sabiendo esto, podemos concluir que cada compuesto químico, en su forma pura, posee sus propiedades físicas bien definidas, con el fin de presentar siempre el mismo comportamiento cuando sus variables de estado presenten un mismo valor, como presión y temperatura, por ejemplo.
La ebullición de una solución
El mismo comportamiento de un compuesto en forma pura no es observado cuando estamos trabajando con soluciones, compuestas por solutos no volátiles, como el café por ejemplo. El polvo de café sería el «soluto no volátil» y el agua el «solvente». Así, la solución tendrá un punto de ebullición diferente de aquél encontrado para el solvente puro, o sea, de agua. Podemos ver en la figura 3 la diferencia entre el punto de ebullición de una solución y del solvente puro.
Según la Tonometría (parte de las propiedades coligativas que estudia la evaporación de los líquidos y soluciones líquidas) la presión máxima de vapor de la solución siempre será menor que la del líquido puro, de tal manera que la curva de la solución estará siempre abajo de la curva del solvente puro. De ese modo, la solución solamente hervirá a una temperatura tsuperior a la de la ebullición del líquido puro, t0. Debido al hecho de emitir menos vapores, será necesario más calor para hervir la solución. El efecto ebuliométrico puede ser expresado, como definición, así:
La elevación de la temperatura de ebullición de la solución (/te) es la diferencia entre temperatura de inicio de ebullición de la solución (t) y la temperatura de ebullición del líquido puro (t0) bajo la misma presión externa.
matemáticamente: Δte= t – t0
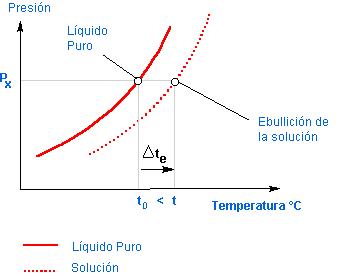
Figura 3 – Punto de ebullición de un líquido y de una solución
