Efectos Coligativos y Ley de Raoult
El agua pura a presión de 1 atm posee el ponto de fusión de 0oC y el punto de ebullición de 100oC.

Agua Pura
Sin embargo, cuando añadimos un soluto no volátil al agua, el soluto modifica las propiedades físicas del agua. Ahora el agua se congela por debajo de 0oC e hierve por encima de 100oC. Estas alteraciones de las propiedades físicas del agua debido a la adición del soluto se llaman efectos coligativos.

Adición de un soluto no volátil al agua
Para cada propiedad física que se modifica tenemos una propiedad coligativa que estudia este efecto:
| EFEITO COLIGATIVO | PROPIEDAD COLIGATIVA |
| Disminución de la presión de vapor | Tonoscopía |
| Aumento del Punto de Ebullición | Ebulioscopía |
| Disminución del Punto de Congelación | Crioscopía |
| Aumento de la Presión Osmótica | Osmoscopía |
Los efectos coligativos dependen únicamente del número de partículas del soluto disueltas. Cuanto mayor sea el número de partículas del soluto disueltas, mayores serán los efectos coligativos.
LEY DE RAOULT
En 1878 el químico francés François-Marie Raoult (1830-1901) afirma que el efecto coligativo de un soluto no volátil molecular en un solvente es directamente proporcional a la molaridad de la solución, es:
Efecto Coligativo = K . W
donde:
K = constante de proporcionalidad
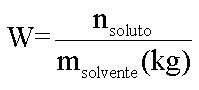
Por lo tanto para los efectos coligativos tendremos:
Tonoscopía
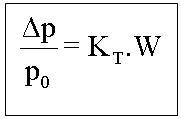
Donde: KT=Constante tonoscópica molar (M solvente/1000)
Ebulioscopia
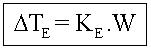
Donde: Ke=Constante ebulioscopía molar (M solvente/1000)
Crioscopia
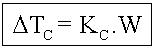
Donde: Kc=Constante crioscópica molar (M solvente/1000)
La destilación fraccionada
La Destilación Fraccionada se emplea cuando la diferencia entre los pontos de ebullición de los líquidos de la mezcla es menor a 80oC. Un aparato más sofisticado y un poco más de tiempo son necesarios.
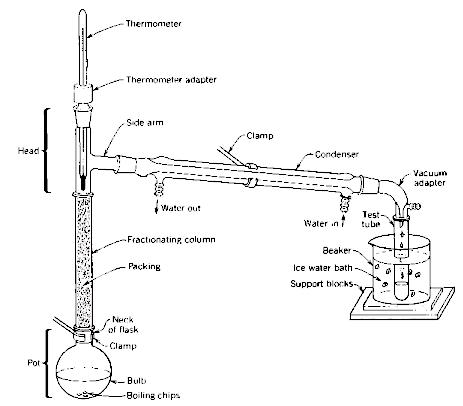
La principal diferencia en el aparato de destilación fraccionada es la presencia de una columna de fraccionamiento. El objetivo de esta columna es crear varias regiones de equilibrio líquido-vapor, enriqueciendo la fracción del componente más volátil de la mezcla en la fase de vapor.
Cuando dos líquidos infinitamente miscibles son puestos juntos, la presión de vapor de cada uno de ellos es reducida por la presión de vapor del otro; cada componente en una solución contribuye proporcionalmente a su fracción molar en la mezcla. La presión total de vapor es igual a la suma de las presiones de vapor ejercidas por cada componente, en la mezcla.
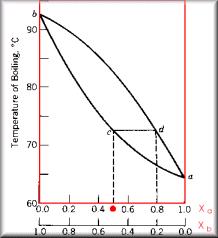
Diagrama de Fase
La composición de fase del vapor no es, necesariamente, igual a la de la fase líquida; el vapor una fracción del componente más volátil mayor que en el líquido. La imagen al lado representa un diagrama de fase para una mezcla entre el líquido b (p.e.=92,5oC) y líquido a (p.e.=65oC). Según el diagrama, una solución cuya composición es de Xa=Xb=0,5 entra en ebullición a 72,5oC (ponto c). Por la imagen, vemos que el punto en equilibrio liquido-vapor (ponto d) refleja una composición de Xa=0,8, o sea, el vapor presenta una fracción de la mayor que en el líquido. Este es el principio de la destilación fraccionada: diversas «destilaciones» son conducidas en la columna de fraccionamiento, y el vapor se va enriqueciendo con el componente más volátil.