Enlace Químico
Los átomos de los elementos de la tabla periódica pueden reaccionar unos con otros, enlazándose químicamente para formar compuestos. Las características físicas y químicas del compuesto formado son completamente distintas de las de los átomos que lo formaron.
Los enlaces químicos se dan por la interacción entre los electrones de los átomos que formarán el compuesto. Hay básicamente dos tipos de enlace químico: en enlace iónico y el enlace covalente.
Enlace iónico.
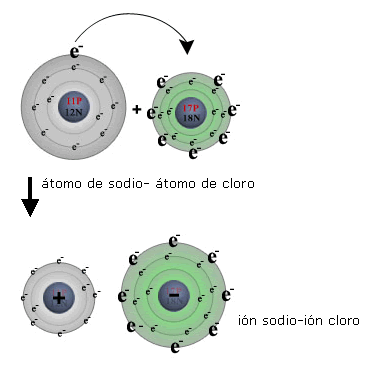
En este tipo de enlace, los electrones se transfieren completamente de un átomo a otro, por lo tanto un átomo pierde electrones, y otro los gana. Ambos se transforman en iones, o sea átomos con carga eléctrica positiva o negativa. Estos iones, al tener cargas contrarias se atraen a través de la fuerza electrostática, y esta es la base del enlace iónico.
Por ejemplo, en la reacción del sodio con el cloro para formar cloruro de sodio (sal común), el átomo de sodio pierde un electrón y queda con una carga positiva; el átomo de cloro gana el electrón y al quedar con carga negativa, sufre una fuerza de atracción por el átomo de sodio, formándose el enlace iónico.
Características del enlace iónico:
Se forman entre metales y no metales.
Los compuestos iónicos se disuelven fácilmente en agua y otros solventes polares.
Los compuestos iónicos conducen la electricidad con facilidad.
Tienden a formar sólidos cristalinos con alto punto de fusión
Enlace covalente.
En este tipo de enlace los electrones no se transfieren de un átomo a otro, sino que los comparten.
El enlace covalente ocurre cuando los átomos que van a formar el compuesto tienen una afinidad similar por los electrones, de modo que ninguno de ellos los gana completamente, sino que los comparten.
Un ejemplo de este tipo de enlace es el que ocurre entre dos átomos de hidrógeno. Ambos átomos tienen un solo electrón de valencia y los dos querrán ganar un electrón más para completar su envoltura, así que ambos comparten los dos electrones.
Algunos átomos pueden formar enlaces covalentes múltiples, por ejemplo el átomo de oxígeno, el cual necesita dos electrones para completar su envoltura de valencia. El oxígeno puede reaccionar con dos átomos de hidrógeno (cada uno tiene un electrón para compartir), para formar una molécula de agua.
Enlaces polares y no polares.
Existen dos subtipos de enlace covalente: el enlace covalente polar y el no polar. En el enlace covalente no polar, los átomos que comparten electrones tienen la misma afinidad por los mismos. Este tipo de enlace sucede entre dos átomos iguales, por ejemplo hidrógeno u oxígeno, al formar H2 y O2.
En el enlace covalente polar, uno de los átomos tiene mayor afinidad por los electrones que el otro, por lo tanto los atrae con más fuerza, pero sin poderlos capturar completamente, como sucede en el enlace iónico. Entonces se forma un dipolo en la molécula del compuesto formado.
Esto es lo que sucede por ejemplo en la molécula de agua, donde el átomo de oxígeno atrae a los electrones hacia sí, formándose un dipolo negativo en torno a éste, mientras que en la zona de los átomos de hidrógeno la carga parcial formada en positiva.
