Momento dipolar de enlace
El momento dipolar de enlace, también llamado momento dipolar químico, se puede definir como la magnitud de la polaridad en un enlace.
Cuando dos átomos se hallan enlazados químicamente, y sus electronegatividades son distintas, el de mayor electronegatividad atraeá a los electrones hacia sí, dando lugar a dos cargas opuestas en el enlace.
El momento dipolar de enlace es el producto entre el valor de las cargas y la distancia que las separa, o sea la longitud del enlace. Así, tenemos el momento dipolar de enlace (μ), definido de la siguiente manera:
![]()
El valor q sería el porcentaje de las cargas compartidas que son atraídas por en átomo en cuestión. Es decir, un átomo con mayor electronegatividad, atraerá los electrones de enlace hacia sí en mayor medida.
La unidad del momento dipolar usualmente son los Debyes. 1 Debye es igual al 1 armstrong por 1 estatocoulombio. En realidad la unidad stándard internacional para el momento dipolar es el coulombio metro, pero es demasiado grande para ser práctica. Estos son algunos factores de conversión que pueden ser útiles:
1 C·m = 2.9979×1029 D
1D = 3.336×10-30 C.m
Los momentos dipolares en moléculas diatómicas varían entre 0 y 11 D. Para poner ejemplos de los extremos, la molécula Cl2 tiene un momento dipolar de 0, o sea que es apolar, mientras de la molécula de KBr en estado gaseoso tiene un momento dipolar de 10,5 D, siento altamente polar.
El momento dipolar de enlace se puede representar con vectores, paralelos al eje de enlace. La dirección del vector siempre es hacia el átomo con mayor electronegatividad.
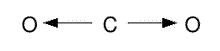
Supongamos una molécula de dióxido de carbono, como vemos en la figura de arriba. Según la diferencia de electronegatividad entre los átomos de oxígeno y carbono, el momento dipolar debería ser distinto de cero. Sin embargo está demostrado experimentalmente que la molécula de dióxido de carbono es apolar. Esto de explica por la geometría de la molécula y la dirección de los vectores μ. Dado que los dos átomos de oxígeno se encuentran a ambos lados del átomo de carbono, los vectores μ se cancelan al ser sumados vectorialmente. Con esto queda demostrado que la polaridad de una molécula depende de los momentos dipolares de enlace así como de la geometría molecular determinada por la teoría de repulsión de los electrones de la capa de valencia (TREPEV). Es decir que debemos considerar el momento dipolar de una molécula como la suma vectorial de los momentos dipolares parciales de cada enlace.
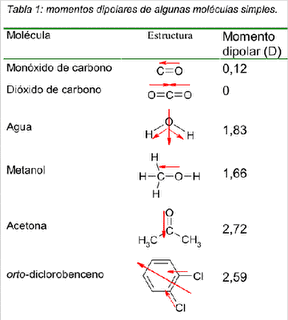
La fuerza de atracción dipolo-dipolo, que aparece entre las moléculas polares, depende del momento dipolar de cada molécula. Mientras mayor sea éste, mayor será la fuerza intermolecular.
