Masa molecular
La masa molecular es la masa de una molécula de un compuesto. Se calcula sumando las masas atómicas relativas de todos los átomos que forman dicha molécula. Se mide en unidades de masa atómica, representadas como u, también llamadas unidades Dalton, representada como Da. Esta última unidad es la indicada en el Sistema Internacional de Magnitudes.
La masa molar coincide numéricamente con la masa molecular, pero son dos cosas distintas.
Mientras que la masa molecular es la masa de una molécula, la masa molar es la masa de un mol de compuesto, es decir, del número de Avogadro de moléculas. La masa molecular en u coincide numéricamente con la masa molar en gramos.
Por ejemplo, el oxígeno (O2) tiene una masa molecular de aproximadamente 32 u, y un mol de oxígeno ( o sea 6,022 × 1023 moléculas de oxígeno) pesa 32 gramos.
En el caso de la molécula de agua H2O, la masa molecular sería:
Masa atómica relativa del hidrógeno: 1,00797 u.
Masa atómica relativa del oxígeno: 15,9994 u.
Entonces:
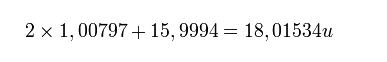
Antiguamente se denominaba peso molecular a esta entidad, pero el nombre correcto es masa molecular.
Para poner un ejemplo de una molécula más compleja, la masa molecular de Fe2 (SO4)3
Masa de Fe: 56 u.
Masa de S: 32 u.
Masa de cada átomo de O: 16 u.
Sumamos entonces la masa de los átomos integrantes de la molécula, multiplicados por sus subíndices y multiplicando a su vez por el número fuera del paréntesis a los átomos que correspondan.
(56 x2) + (32×3) + (16×12)=400u.
La masa molecular del Fe2 (SO4)3 es entonces 400 u, y la masa de un mol de esta sustancia es 400 gramos.
La masa molecular de algunos compuestos se puede medir experimentalmente. Por ejemplo, se puede medir la masa molecular del butano con un sencillo experimento de laboratorio.
Tomamos una bureta graduada, la llenamos de agua y la colocamos invertida en un recipiente con agua. Por otro lado, tomamos un encendedor común, que contiene gas butano como combustible, y lo pesamos. Luego sumergimos el encendedor en el agua, lo colocamos dentro de la bureta y liberamos el gas contenido en él. Pesamos el encendedor vacío. El peso en gramos de gas butano es igual al peso del encendedor lleno menos el peso del encendedor vacío.
El volumen de gas butano liberado en la bureta se puede medir gracias a la graduación de la misma. Si medimos la temperatura con termómetro y la presión atmosférica, podemos despejar número de moles de gas butano de la fórmula de los gases ideales.
P.V=n RT
n=P.V/RT
Donde n es número de moles, P es la presión, T es la temperatura en grados Kelvin, R es la constante universal de los gases ideales y V es el volumen.
Entonces, sabiendo el número de moles de gas butano y la cantidad de gramos de gas butano, su masa molar será la división entre gramos y moles. Como la masa molar coincide numéricamente con la masa molecular, habremos obtenido un valor para masa molecular del butano.
