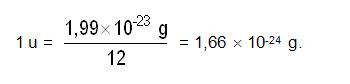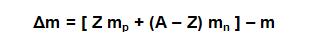Masa atómica
La masa atómica de un átomo es la suma de las masas de todos los protones y neutrones que lo componen. Existen diferencias entre la definición de masa atómica y de masa atómica relativa, masa atómica media o peso atómico.
La masa atómica de diferentes isótopos de un mismo elemento, difieren entre sí. En algunos elementos encontramos que existe un isótopo que es más común que los otros, y la diferencia entre su masa atómica y la masa atómica relativa o peso atómico estándar es suficientemente pequeña como para no afectar algunos cálculos, pero esta diferencia puede ser importante en otros casos.
La unidad en que se mide la masa atómica se llama justamente unidad de masa atómica (u.m.a) Esta unidad es también llamada Dalton, (Da) en honor al químico John Dalton. La u.m.a corresponde a la doceava parte de la masa del núcleo del carbono-12, que es el isótopo más abundante de este elemento. El valor de una u.m.a es también muy cercano a la masa de un protón.
Si tenemos en cuenta que un mol de cualquier sustancia contiene el número de Avogardo de partículas y un mol de carbono 12 tiene una masa de 12 gramos, se podría decir que:
Entonces el valor de una u.m.a sería :
La masa del protón es mp = 1,00728 u y la masa del neutrón, mn = 1,00867 u.
Muchas veces se denomina masa atómica al promedio de masas de los distintos isótopos de un elemento, lo que conlleva algunas inexactitudes en algunos cálculos. De todas maneras, el valor de masa atómica para un isótopo en particular tampoco coincide exactamente con el valor sumado de las masas de sus protones y neutrones. Esto se debe al fenómeno llamado “defecto de masa”.
Lo que sucede es que en la fusión de elementos más ligeros que el hierro, se produce energía y se pierde masa, entonces la masa medida experimentalmente es menor que la de la suma de nucleones. La masa perdida se ha transformado en energía, de acuerdo con la teoría elaborada por Einstein, donde E= mc2. Esta energía se ha utilizado para mantener unidos a las partículas que componen el núcleo. En los elementos más pesados que el hierro, la fusión nuclear requiere energía, entonces sucede todo lo contrario, la masa medida experimentalmente es mayor que la suma de las masas de protones y neutrones del núcleo.
Este defecto de masa, se puede calcular según la siguiente fórmula:
Donde Z es el número atómico, A es el número másico, mp es la masa del protón, mn la masa del neutrón y m la masa medida experimentalmente.
Por ejemplo, para el caso del helio, cuyo núcleo está compuesto por dos protones y dos neutrones, y la masa medida experimentalmente corresponde a 4,00151 u, el defecto de masa sería el siguiente: