La Longitud de enlace
La molécula de hidrógeno (H 2) es una de las moléculas más simples que existen, por lo que es el mejor punto de partida para ilustrar las fuerzas que intervienen en la interacción covalente entre dos átomos. La figura 1 muestra una curva de energía potencial (E p) [x potencial energético total de la distancia internuclear (o interatómicas)], que muestra la variación de la energía en la formación de H 2 molécula.
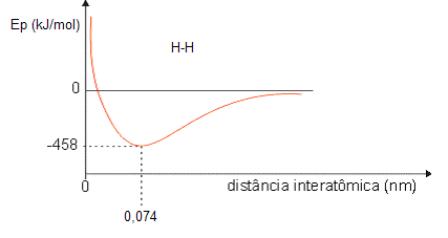
La curva de energía potencial para el H 2 (1 nm = 10 -9 metros).
Considere el valor de p E = 0 como la energía potencial de dos átomos de hidrógeno aislado (sin interacción covalente).
A raíz de la Figura 1, tenga en cuenta que cuando los átomos de H están separados a gran distancia, casi no hay interacción electrostática entre ellos, y la energía total es dada por la suma de las energías de los átomos solo (p E = 0). Tras una inspección más cercana (a pie a la izquierda de la gráfica), comienzan a actuar más intensamente a las fuerzas de atracción entre el núcleo de un átomo y el electrón de otro átomo. Al mismo tiempo también crecen en menor medida, las fuerzas de repulsión entre los núcleos y también entre los dos electrones de los átomos. El predominio de las fuerzas de atracción hace que los átomos que se acercan más y más, la reducción de la energía potencial del sistema (representado por la ordenada de la gráfica), hasta que la energía potencial alcanza su valor mínimo («bien» de la energía potencial). En esta situación, hay un equilibrio entre las fuerzas de atracción y repulsión, lo que inter nuclear estabilidad mayor distancia (distancia internuclear de equilibrio).
La existencia de un «mínimo» de energía en la curva de energía potencial de una molécula que caracteriza a una situación de mayor estabilidad (menor energía) que los átomos aislados. En otras palabras, un pozo de energía potencial representa un estado ligado. En este punto, se considera que forma un enlace químico.
En el caso de H 2, el pozo de potencial se relaciona con la situación de intercambio de dos electrones de valencia, lo que lleva a la formación de un enlace sencillo [(más tarde llamado enlace sigma (σ)]. La molécula de H 2 en su conjunto adquiere la configuración electrónica similar a la Se elemento.
En caso de que hubiera una relación más estrecha entre los átomos de hidrógeno (el más a la izquierda del pozo de potencial – Figura 1), hubo un aumento repentino en la energía potencial del sistema y disminuir la estabilidad de la molécula. En esta región, las fuerzas de repulsión sobre todo electrón-electrón y el núcleo-núcleo sería predominante, dando lugar a un drástico aumento en la energía potencial, desestabilizar el estado ligado y la destrucción de la molécula.
El equilibrio entre las fuerzas de atracción y repulsión en el enfoque de dos átomos se caracteriza por la presencia de una potencia en la curva de potencia del sistema. En este punto, la estabilidad de los enlaces covalentes es máxima. El sistema se conectó, la gráfica de p E x distancia internuclear da la longitud (eje de abscisas) y energía (ordenada) de enlace covalente.
