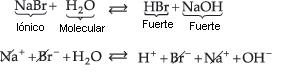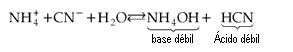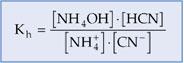Hidrólisis de Sales
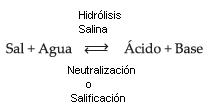
Llamamos hidrólisis salina a la reacción entre una sal y el agua, produciendo el ácido y la base correspondientes. La hidrólisis de sal es, por lo tanto, la reacción inversa de la neutralización.
Para simplificar el análisis de los fenómenos de la hidrólisis salina, las sales se dividen en 4 tipos, a saber:
1) Sal de ácido fuerte y base débil;
2) Sal de ácido débil y base fuerte;
3) Sal de ácido débil y base débil;
4) Sal de ácido fuerte y base fuerte.
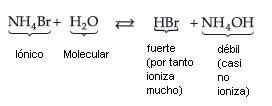
14.1. Sal de Ácido Fuerte y Base Débil
Resulta:
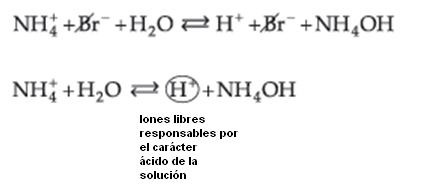
Podemos observar que quién sufre la hidrólisis no é la sal, pero el Ion NH4+ (de la base débil), liberando iones H+, que confieren a la solución carácter ácido con pH menor que 7.
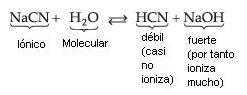
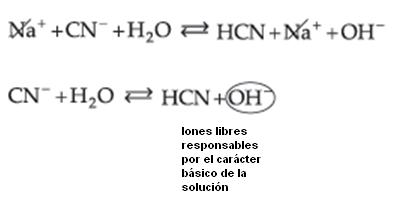
Sal de Ácido Débil y Base Fuerte
Resulta:
Observamos que quién sufre la hidrólisis, en este caso, es el Ion CN– (del ácido débil), liberando iones OH– que confieren a la solución carácter básico con pH mayor que 7.
Sal de Ácido Débil y Base Débil
Resulta
Como tanto el ácido como la base son débiles, ocurre realmente la hidrólisis de sal y no simplemente de uno de los iones (como en los dos casos anteriores). Podemos concluir que quién sufre hidrólisis son los iones correspondientes al ácido y/o base débiles.
En este caso, el medio puede quedar ácido, básico o neutro.
• El medio será ligeramente ácido si la ionización del ácido es mayor que la de la base (Ka > Kb);
• El medio será ligeramente básico si la ionización del ácido es menor que la de la base (Ka < Kb).
• El medio será neutro si la ionización del ácido presenta la misma intensidad que la de la base (Ka Kb).
Sal de Ácido Fuerte y Base Fuerte
Resulta:
Siendo NaOH una base fuerte, los iones Na+ no captan los iones OH– del agua. Del mismo modo, siendo HBr un ácido fuerte, los iones Br– no captan los iones H+ de agua. Por lo tanto, en este caso, no hay hidrólisis. La solución tendrá carácter neutro, con pH igual a 7.
Concluimos que, en la solución salina, predomina siempre el carácter del más fuerte. Cuando la sal es formada por ácido/base de una misma fuerza (2 fuertes), la solución final es neutra.
| Tipo de Sal | Ejemplo | Carácter | pH |
| Sal de ácido fuerte y base débil | NH4Br | Ácido | Menor a 7 |
| Sal de ácido débil y base fuerte | NaCN | Básico | Mayor a 7 |
| Sal de ácido débil y base débil | NH4CN | a- Ácido
b- Neutro c- Básico |
a- Menor 7
b- Igual 7 c- Mayor 7 |
| Sal de Ácido fuerte y base fuerte | NaBr | Neutro | Igual a 7 |
Grado de Hidrólisis (αh)
Se define el grado de hidrólisis (αh) de una sal como:
La variación de αh es:
0 < αh < 1 o 0% < αh < 100%
Constante de Hidrólisis (Kh)
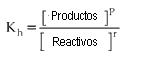
Paral os equilibrios químicos de las reacciones de hidrólisis, se define una constante de equilibrio llamada constante de hidrólisis (Kh).
Dado el equilibrio de hidrólisis:
La constante de hidrólisis será:
Observación:
El agua no entra en la expresión porque es el solvente y su concentración molar es prácticamente constante.
En general:
donde p y r son los coeficientes de la ecuación.
Recuerde: el agua no entra en la expresión y Kh se obtiene siempre desde la ecuación iónica de hidrólisis.