Constante de disociación ácida
Cuando un ácido fuerte se disuelve en agua, se disocia casi completamente, es decir, en prácticamente de todas sus moléculas se separa un protón, que se libera al medio. Cuando el ácido es débil, el ácido no se disocia completamente al disolverse en agua, sino que sólo algunas moléculas liberan un protón, mientras que otras no lo hacen. La forma disociada y sin disociar del ácido débil permanecen en equilibrio químico en el medio acuoso.
![]()
La constante de disociación ácida K se puede definir como una relación entre las concentraciones de ácido disociado y sin disociar.
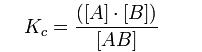
En los ácidos fuertes K adquiere mayor valor, dado que las concentraciones de A y B serán altas y la concentración AB (ácido sin disociar) será baja. Si el valor de K para un ácido es bajo, esto significa que es un ácido débil, se disocia escasamente, por lo tanto las concentraciones de A y B serán bajas, y la concentración de AB será elevada.
Por lo tanto, podemos decir que la constante de disociación ácida K, es una medida cuantitativa de la fuerza de un ácido.
También se le llama constante de disociación ácida al pKa, que es el resultado de -log10 Ka. De esta manera, para los ácidos fuertes, con valor elevado de Ka, el pKa es pequeño, mientras que en ácidos débiles, con Ka de poco valor, es pKa es elevado.
Según la definición de Arrhenius, un ácido es una sustancia que presenta disociación en solución acuosa, liberando un protón al medio. Sin embargo, como este protón liberado tiende a unirse a la molécula de agua, formando el ión hidronio (también denominado oxonio), Arrhenius indicó que la reacción de disociación de un ácido debería ser escrita como una reacción ácido-base, como vemos a continuación:
HB + H2O → B− + H3O+
Tomemos por ejemplo el ácido acético. Cuando se encuentra en solución acuosa, este ácido puede perder el protón de su grupo carboxilo, para dar lugar a su base conjugada (acetato). Su pKa a 25°C es de 4.8, lo que significa que en un medio con pH 4,8, más o menos la mitad de sus moléculas se encontrarán disociadas. Es un ácido débil, y su constante de disociación Ka a 20 grados Celsius es 1,75·10-5.
En la siguiente tabla podemos observar una lista de algunos ácidos orgánicos con su respectiva constante de acidez:
| Nombre | K | pK |
| Acido fórmico | 1.86 x10-4 | 3.732 |
| Acido ciánico | 3.54×10-4 | 3.451 |
| Acido cianhídrico | 5.85×10-10 | 9.233 |
| Acido cloroacético | 1.36 x 10-3 | 2.866 |
| Acido dicloroacético | 5.68×10-2 | 1.246 |
| Acido benzoico | 6.31 x 10-5 | 4.200 |
| Acido láctico | 1.37×10-4 | 3.863 |
| Acido hidrazoico | 2.37×10-5 | 4.625 |
