Conductimetría – Aplicaciones de la titulación conductimétrica
Ácido fuerte con base fuerte – La conductancia inicialmente disminuye en virtud de la sustitución del ión hidrógeno (Λ ∞ = 350) por el catión del titulante (Λ ∞ = 40 – 80) y después de punto de equivalencia crece rápidamente con la adición de exceso del álcali fuerte, en virtud del gran valor de Λ ∞ del ion hidróxido (198).
Los dos segmentos de la curva son rectilíneos dese que el volumen del reactivo adicionado fuera despreciable y la intersección da el punto final; son las curvas 1 y 2 del gráfico 1, debajo.
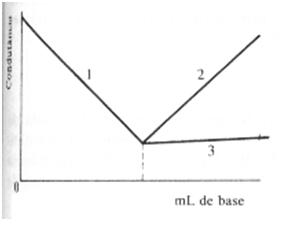
Gráfico 1 – Titulación de ácido fuerte con base fuerte (curvas 1 y 2)
Y titulación de ácido fuerte con base débil (curvas 1 y 3).
Acido fuerte con base débil – La titulación de un ácido fuerte por una base moderadamente débil (Kb = 10-5) puede ser ilustrada por la neutralización del ácido sulfúrico diluido por una solución diluida de amoníaco (curvas 1 y 3 del gráfico presentado).
El primer segmento de la curva refleja la desaparición de los iones hidrógeno durante la neutralización; luego del punto final, el gráfico queda casi horizontal, pues el exceso de amoníaco acuoso no está apreciablemente ionizado en la presencia de sulfato de amonio.
Ácido fuerte con base fuerte – En este caso, la forma de la curva dependerá de la concentración del ácido y de su constante de ionización Ka. Así, en la neutralización del ácido acético (Ka @ 1,8 . 10-5) con solución de hidróxido de sodio, la sal formada en la primer parte de la titulación (acetato de sodio) tiende a reprimir la ionización del ácido acético aún presente en la solución, de forma que la conductancia disminuye.
La elevación de la concentración de la sal, sin embargo, tiende a provocar un aumento de la conductancia.
En virtud de estos dos factores opuestos, las curvas de titulación pueden tener un mínimo cuya posición dependerá de la concentración y de la fuerza del ácido débil.
Cuando la titulación avanza, habrá una alteración un tanto indefinida del punto final y el gráfico queda lineal luego de que todo el ácido ha sido neutralizado.
En el gráfico 2, a continuación, aparecen algunas curvas de titulaciones del ácido acético por el hidróxido de sodio, es claramente imposible fijarla en un punto final exacto.
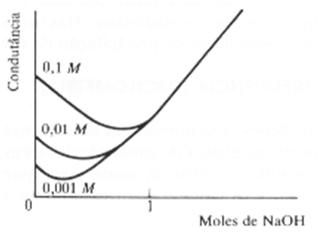
Gráfico 2 – Titulación del ácido débil con base fuerte
Ácido débil con base débil – La titulación de un ácido débil por una base débil puede ser realizada con facilidad y es frecuentemente preferible la titulación con una base fuerte. El gráfico a continuación es la titulación del ácido acético 0,003 mol/L por una solución de amoníaco 0,0973 mol/L.
La curva de neutralización hasta el punto de equivalencia es semejante a la que se obtiene con solución de hidróxido de sodio, pues el acetato de sodio y el acetato de amonio son electrolitos fuertes.
Luego del punto de equivalencia, el exceso de solución acuosa de amoníaco tiene pequeño efecto sobre la conductancia, pues la disociación de la base es fuertemente reprimida por la sal de amoníaco presente en la solución.
Las ventajas sobre la titulación con álcali fuerte son la facilidad de fijar el punto final y la menor influencia del dióxido de carbono, que puede ser despreciada en soluciones diluidas.
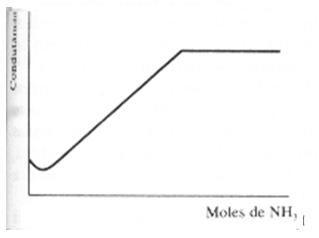
Gráfico 3 – titulación del ácido débil con base débil
