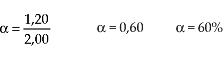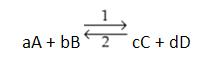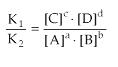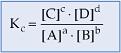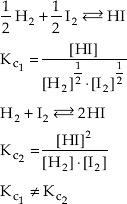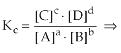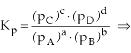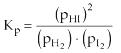El Equilibrio Químico
Definición: Ocurre cuando, en una reacción reversible, la velocidad de la reacción directa es igual a la velocidad de la reacción inversa. Una vez alcanzado el estado de equilibrio, las concentraciones de reactivos y productos permanecen constantes. Consideremos la ecuación genérica:
donde:
– v1 es la velocidad de la reacción directa y v2 la velocidad de la reacción inversa.
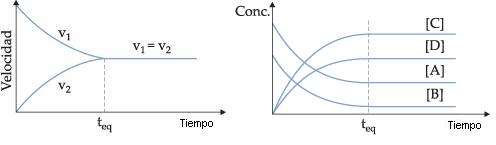
A principio v1 es lo máximo porque las concentraciones de A y B presentan valores máximos, mientras que v2 es igual a cero, porque C y D todavía no fueron formados. En la medida que la reacción ocurre, A y B disminuyen, y C y D aumentan, por lo tanto v1 disminuye y v2aumenta, hasta que las dos velocidades se igualen. En el momento en que v1 = v2, podemos decir que el sistema logra el estado de equilibrio.
Logrado el estado de equilibrio, la reacción química sigue ocurriendo (nivel microscópico) en los dos sentidos, con la misma velocidad y, por lo tanto, las concentraciones de reactivos y productos quedan constantes. Por eso, podemos decir que el equilibrio es un equilibrio dinámico.
Al considerarse el sistema como un todo (nivel macroscópico), aparentemente la reacción se detuvo, porque las concentraciones de reactivos y productos permanecen inalterados indefinidamente.
Para que se logre el estado de equilibrio, es necesario que:
– el sistema se encuentre en un recipiente fechado;
– la temperatura permanece constante.
Gráficamente, podemos representar:
Clasificación
Los equilibrios químicos pueden ser clasificados en homogéneos y heterogéneos.
Equilibrio Homogéneo
Es aquél en que todos los participantes se encuentran en una única fase. Por lo tanto, clasificamos el sistema como siendo homogéneo.
H2(g) + I2(g) <==> 2HI(g)
HCN(aq) <==> H+(aq) + CN–(aq)
Equilibrio Heterogéneo
Es aquél en que los participantes se encuentran en más de una fase. Por lo tanto, clasificamos el sistema como siendo heterogéneo.
C(s) + O2(g) <==> CO2(g)
Grado de Equilibrio (α)
Indica el porcentaje en moles de una determinada especie que reaccionó para establecer el equilibrio. Podemos representar:
Ejemplo
Consideramos la reacción x → y + z, en que, a principio, encontramos 2,00 moles de x y en equilibrio son encontrados 0,80 moles de x sin reaccionar. Concluimos, entonces, que reaccionó 2,00 – 0,80 = 1,20 moles de x. El grado de equilibrio queda:
Concluyendo, podemos decir que cuanto mayor el valor de α en equilibrio, encontramos menor resto de reactivos en mayor cantidad de productos. Cuanto menor el valor de α en equilibrio, encontramos mucho resto de reactivos y poco producto.
Constante de Equilibrio en Término de las Concentraciones Molares (Kc)
Dada una reacción reversible cualquiera:
Aplicándose la ley de la acción de las masas de Guldberg-Waage, tenemos:
• para la reacción directa:
v1 = K1 · [A]a · [B]b
• para la reacción inversa:
v2 = K2 · [C]c · [D]d
En equilibrio: v1 = v2
K1 · [A]a · [B]b = K2 · [C]c · [D]d
La relación k1/k2 es constante y se llama constante de equilibrio en términos de concentración molar (Kc):
La constante de equilibrio Kc es, por lo tanto, la razón de las concentraciones de los productos de la reacción y de las concentraciones de los reactivos de reacción, todas elevadas a exponentes que corresponden a los coeficientes de la reacción.
Observaciones
a) La constante de equilibrio Kc varía con la temperatura;
b) Cuanto mayor el valor de Kc , mayor el rendimiento de la reacción, ya que en el numerador tenemos los productos y en el denominador los reactivos. Por lo tanto, comparando valores de Kc en dos temperaturas diferentes, podemos saber en cual de estas la reacción directa presenta mayor rendimiento;
c) El valor numérico de Kc depende de como es escrita la ecuación química.
Por ejemplo:
Por este motivo debemos escribir siempre la ecuación química junto con el valor de Kc.
d) La constante de equilibrio es adimensional, o sea, no posee unidad.
Constante de Equilibrio en Términos de las Presiones Parciales (Kp)
Cuando los componentes del equilibrio son substancias gaseosas, además de la constante Kc, podemos expresar la constante de equilibrio en términos de presiones parciales (Kp).
Así para la reacción:
la constante de equilibrio puede ser:
constante de equilibrio en términos de concentración molar Kc ó
constante de equilibrio en términos de presiones parciales Kp
Por lo tanto, concluimos que Kp es la razón entre el producto de las presiones parciales de los productos gaseosos y el producto de las presiones parciales de los reactivos gaseosos, estando todas las presiones elevadas a exponentes iguales a los respectivos coeficientes, en la ecuación química balanceada.
Por ejemplo:
H2(g) + I2(g) <=> 2HI(g)
Observación
Para equilibrio en sistema heterogéneo, el estado sólido no participa de las expresiones Kp y Kc, el estado líquido participa solamente de Kc, y el estado gaseoso participa de las dos expresiones.