Principales Nociones de Solubilidad
Cálculo del Producto de Solubilidades (Kps)
El producto de Solubilidad es constante de equilibrio correspondiente al equilibrio de disolución de sustancias iónicas.
Esta constante es calculada por el producto de las concentraciones de equilibrio de los iones involucrados elevadas a los respectivos coeficientes estequiométricos en el compuesto en causa.
Enunciado:
Consideremos el siguiente equilibrio de disolución:
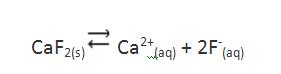
Sabiendo que la solubilidad del fluoruro de calcio a 18ºC es de 0,016 g/l, se pretende determinar el valor del producto de solubilidad.
Resolución: Así, sabiendo que la masa molar del CaF2 es 78 g/mol, se determina la solubilidad molar del compuesto:
![]()
A través del equilibrio de disolución, se observa que por cada mol de CaF2 que se disuelve, se forma 1 mol de Ca2+ y 2 moles de F–. Así, en equilibrio, las concentraciones de los iones serán:
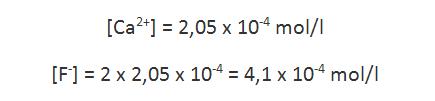
Conociendo las concentraciones de los iones en equilibrio, es posible determinar el producto de solubilidad que, en este caso, corresponde al producto de la concentración de iones calcio por el cuadrado de la concentración de iones fluoruro:
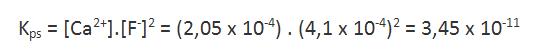
Determinación De Cociente de Reacción (Q)
Consideremos una mezca de 200 mililitros de una solución acuosa 0,10 mol/dm3 de nitrato de plata (AgNO3) en 300 mililitros de una solución acuosa 0,20 mol/dm3 de sulfato de sodio (Na2SO4), a 25 grados centígrados.
![]()
El precipitado que se podrá formar es Ag2SO4, con el siguiente equilibrio de disolución:
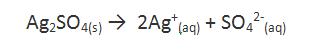
Para determinar si existe o no formación de precipitado, es necesario determinar el Q, definido de la siguiente forma:
![]()
Para esto es necesario conocer los valores de las concentraciones de los iones Ag+ y SO42-.
Estos valores se calculan teniendo en cuenta los valores de las concentraciones iniciales:
- El número de moles de Ag+ presentes en los 200 mililitros (0,2 dm3) iniciales es de:
0,10 moles/ dm3 *0,2 dm3 = 0,02 moles Ag+.
Como el volumen pasa al valor de 500 ml (200 + 300) al juntar las dos soluciones, la concentración de iones Ag+ en la solución final es de:
0,02 mol Ag+ / 0,5 dm3 = 0,04 mol Ag+/dm3
El número de moles de SO42- presentes en los 300 ml (0,3 dm3) iniciales es de:
0,20 mol/dm3 * 0,3 dm3 = 0,06 mol SO42-
Para los 500 ml finales, la cocentración de iones SO42- en la solución final es de:
0,06 mol SO42- / 0,5 dm3 = 0,12 mol SO42-/dm3
Determinamos entonces el valor de Q y obtenemos entonces:
Q= 0,04*0,12 = 4,8 x 10-3
Por esta determinación podemos concluir que el valor de Q es mayor que el de Kps. O sea
Q>Kps
De esta forma, la solución está sobre saturada, existiendo entonces precipitación de Ag2SO4 hasta el punto que:
[Ag+]2.[ SO42-]= 1,4×10-4
