Enlace flexionado
El enlace flexionado es un tipo de enlace covalente cuya disposición geométrica tiene cierta semejanza con la forma de una banana.
Tomemos por ejemplo la molécula de eteno o etileno. La estructura de Lewis para esta molécula es la siguiente:
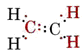
El doble enlace entre carbonos se forma gracias al traslape de dos orbitales híbridos sp3. Como estos orbitales no se encuentran exactamente uno frente a otro, al hibridarse adquieren la forma de banana que se puede observar en la siguiente figura:
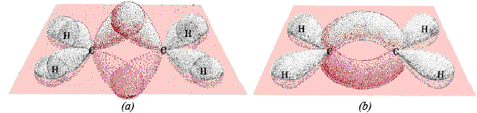
En la figura (a) vemos que los orbitales que se hibridarán no coinciden exactamente en el plano, entonces se hibridan como se ve en la figura (b) adquiriendo una forma curva, que recuerda la forma de una banana.
Todos los enlaces químicos tienen la posibilidad de flexionarse, este fenómeno no ocurre sólo en los enlaces dobles, sino que se puede observar en todos los casos en los que esta forma curva brinda mayor estabilidad al enlace.
El enlace flexionado permite explicar algunas características de los enlaces dobles. Por ejemplo, se ha demostrado experimentalmente que la distancia entre dos carbonos unidos por enlace simple es mayor que la distancia entre dos carbonos unidos en enlace doble.
La longitud del enlace simple entre carbonos es de 156 picómetros, mientras que en el enlace doble, la distancia entre los átomos es de 133 picómetros. Esto se explica mediante la flexión del doble enlace, que al curvarse, acerca los átomos de carbono, haciendo que se aproximen a una distancia menor que en un enlace sencillo.
Además, el enlace flexionado es el responsable del fenómeno de barrera de rotación. Esto significa que el enlace flexionado no se puede girar libremente como otros enlaces, sino que el ángulo de giro está limitado, por la manera en que se encuentran dispuestos los electrones.
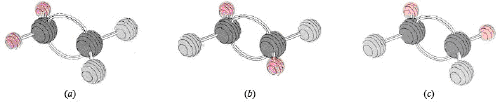
Pongamos por ejemplo los posibles isómeros del difluoroeteno. La fórmula de este compuesto es C2H2F2. En la figura de arriba podemos observar las distintas posiciones que pueden tomar los átomos de flúor. En el caso (a), los átomos de flúor se encuentran unidos al mismo carbono.
En el caso (b) y (c ) dichos átomos se encuentran unidos a distintos carbonos, y difieren sólo en un giro de 180 grados de un extremo de la molécula. Si este giro fuera posible, las formas b y c se convertirían unas en otras rápidamente.
Sin embargo esto no sucede, los isómeros cis (donde los átomos de flúor se encuentran del mismo lado, figura c) no se convierten en isómeros trans (los átomos de flúor en lados opuestos, figura b), gracias al efecto de barrera de rotación del enlace flexionado.
