Electronegatividad
Ya conocemos el modelo atómico y sabemos que el posee un núcleo positivo circundando por una atmósfera negativa. Lo que mantiene los electrones en torno del núcleo es la atracción magnética que uno ejerce sobre el otro. Recordando un poco los conceptos de electromagnetismo, en Física, sabemos que la fuerza eléctrica entre dos cuerpos es directamente proporcional a la carga e inversamente proporcional a la distancia al cuadrado.
Traduciéndolo, cuanto más carga tenga un cuerpo, más ele atraerá o repelerá otro cuerpo y cuanto más lejos el esté, menos el logrará esa atracción o repulsión.
Si el átomo posee un núcleo positivo, es de esperarse que el consiga atraer cuerpos negativos (en el caso, electrones) pero, si el posee una electrosfera (que es negativa) podemos suponer también que la mayor distancia a la que el núcleo puede llegar de un cuerpo negativo es el tamaño del rayo de la electrosfera, debido a la fuerza de repulsión que comienza a aparecer.
Tal como se ve aquí:
Cuando una partícula va acercándose al núcleo, atraída por el, se aproxima también a la electrosfera, solo que esta la repele. De esta forma existe, en teoría, un punto de equilibrio que se localiza aproximadamente a una distancia igual al radio atómico del núcleo del átomo.
¿Y que sucede cuando un átomo llega cerca de otro?
Uno comienza a atraer los electrones más externos de la electrosfera del otro, en tanto el núcleo intenta retenerla. Lo que sucede es una verdadera pelea entre los núcleos, cada uno intentando atraer los electrones externos del otro.
A esa fuerza que el átomo tiene para capturar electrones de otros (o sea, vencer la pelea) se le da el nombre de electronegatividad. Así un átomo es muy electronegativo cuando tiene facilidad en robar los electrones de otros.
¿Y cual es el átomo más fuerte y el más débil?
Si analizamos nuevamente la expresión de la fuerza magnética, vamos a percibir que dos factores son importantes para aumentar la electronegatividad: la carga nuclear, capaz de atraer los electrones, el radio atómico, que determina la distancia máxima de aproximación del electrón en relación al núcleo.
Sucede que la fuerza es directamente proporcional a la carga e inversamente proporcional al radio al cuadrado. Concluimos entonces, que si duplicamos la carga nuclear, la fuerza se duplica, pero, si duplicamos el radio, la fuerza disminuye cuatro veces, por tanto, el radio atómico influye mucho mas en la electronegatividad que la carga nuclear.
Un átomo fortachón debe ser pequeño y con un núcleo lleno de protones.
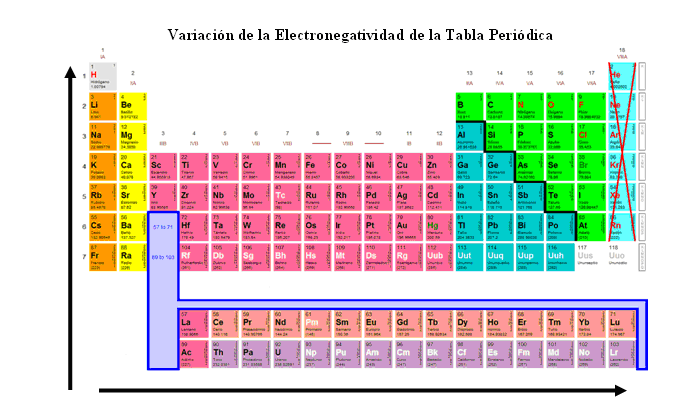
Pensando en la tabla periódica, sabemos que cuanto mayor el período (línea) de la tabla, mas capas tendrá su electrosfera y por consecuencia, mayor su radio atómico, lo que disminuye su electronegatividad.
Átomos que están en el mismo período, tienen el mismo número de capas, por tanto sus radios están muy próximos, pero, a medida que nos desplazamos para la derecha de la tabla y el número atómico crece, crece también el número de protones, la carga nuclear y por ende, la electronegatividad.
Así, la electronegatividad crece en la tabla desde abajo hacia arriba y de la izquierda para la derecha. Como los gases nobles no intentan robar electrones de nadie, los excluimos de esta propiedad, entonces tenemos que;
El elemento más electronegativo es el Flúor y el menos electronegativo es el Francio. Es bastante útil que tengamos a mano a fin de recordar la regla, una pequeña fila de electronegatividad decreciente:
F > O > N > Cl > Br > I > S > C > P > H
La electronegatividad es una propiedad fundamental para entender por ejemplo los tipos de enlaces químicos, la polaridad de una molécula, entre otras particularidades.
Medición de la Electronegatividad
Para aquellos que creen que no se puede, claro que si que es posible medir la electronegatividad. Ya Linus Pauling propuso una escala que atribuye el valor 4.0 para el átomo más electronegativo (Flúor) y los valores para los restantes átomos son atribuidos en comparación. Podemos probar experimentalmente que el átomo de Boro, por ejemplo, atrae los electrones con la mitad de fuerza que el átomo del Flúor, así la electronegatividad del Boro es de 2.0 en la escala de Pauling.
Y es en esta misma escala que, un átomo con electronegatividad 1.5 atrae los electrones de otro con una fuerza igual a 3/8 de la fuerza con que el Flúor lo hace.