El Puente salino
Para evitar la mezcla de las soluciones, se utiliza un puente salino, que une los dos compartimientos del electrodo y completa el círculo eléctrico. El puente salino está formado por un gel que contiene solución salina acuosa concentrada dentro de un tubo. La solución salina más utilizada es el KCl, ya que los iones K y Cl no afectan las reacciones que suceden en las células.
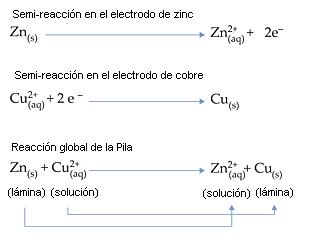
A medida que la lamina de Zinc corroe, la solución del electrodo de Zinc va ganando Cationes Zn2+(aq) (cargas positivas). Ocurrira en el electrodo exceso de cargas positivas.
A medida que la laminas de cobre tiene su masa aumentada, la solución del electrodo de cobre va perdiendo cationes Cu2+(aq) (cargas positivas). Ocurrirá en el electrodo exceso de cargas negativas So42-(aq)
La función del puente salino es mantener el equilibrio eléctrico de cargas positivas y negativas en las soluciones de los electrodos. Así, K migra del puente para el electrodo de cobre y Cl migra para el electrodo de Zinc.
En el conductor existe una cadena de electrones.
En el puente salino existe una cadena de iones
Observación
Si entre las dos soluciones es encontrada una placa porosa, al revés de un puente salino, ocurre una migración de iones existentes en las soluciones, o sea, Iones Zn2+ migran a través de la placa para el electrodo de Cu e iones SO42- migran para el electrodo de Zn. En conclusión, podemos decir que los cationes migran hacia el cátodo y los aniones migran hacia el ánodo.
Reacción Global de la Pila
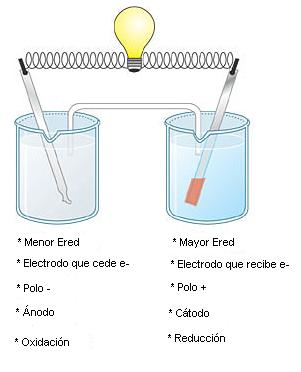
Nomenclatura de los Electrodos
Esquema y Representación
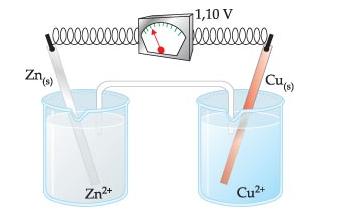
Midiendo la ddp de una pila
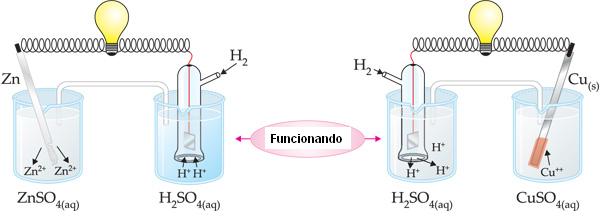
Experimento: Sea la pila de Daniell, en la cual intercalaremos en el hilo conductor un voltímetro (aparato usado para medir la ddp)
La ddp registrada para la pila de Zinc-Cobre es igual a 1,10 V, o sea, la ddp entre los electrodos de Zinc y Cobre es igual a 1,10 V.
Teóricamente la ddp es calculada de la siguiente forma:
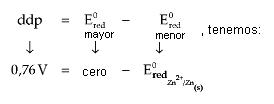
ddp = E0red mayor – E0red menor ó dpp = E0oxi + E0red
La medida del Ered absoluto de un electrodo es imposible y, siendo así, la ecuación detallada arriba posee dos incógnitas, ya que el único valor obtenido en la práctica es la ddp.
No siendo posible medir el valor absoluto de Ered de un electrodo, vamos a trabajar con potencias relativas, y para tanto a elegir un electrodo padrón. El escogido fue el electrodo de Hidrógeno al cual se le atribuye el E0red = cero.
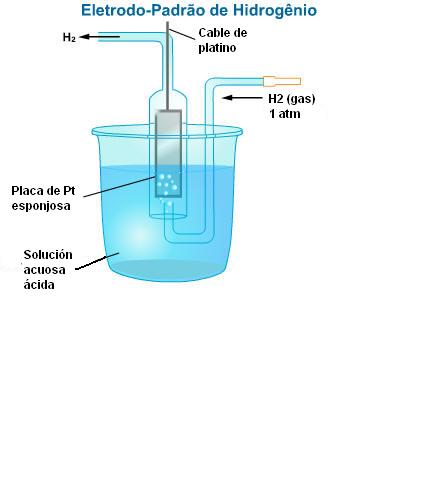
El Electrodo de Hidrógeno (Estándar)
En el interior de un tubo invertido se coloca una lámina de platino unida a un hilo también de platino. El sistema es sumergido en una solución acuosa 1,0 M de H2SO4. Se inyecta en la abertura lateral del tubo Hidrógeno sobre presión de 1 ATM, a 25°C. Parte del Hidrógeno se adhiere a la superficie de platino, a éste fenómeno lo llamamos de adsorción.
El gas adsorbido en la placa crea una película de H2 sobre la platina y el conjunto funciona como si fuese una placa de Hidrógeno, sumergida en una solución conteniendo cationes (electrodo de Hidrógeno)
Observación: El platino, por ser un metal inerte, no reacciona con el H2SO4(aq)
Reacciones en el electrodo de Hidrógeno:
– Perdida de e–: H2(g) => 2H+(aq) + 2e– E0 = 0,00 V
– Aumento de e–: 2H+(aq) + 2e– => H2(g) E0 = 0,00 V
Medida de Potencial de Reducción de un Electrodo (Relativo)
Observe el siguiente experimento:
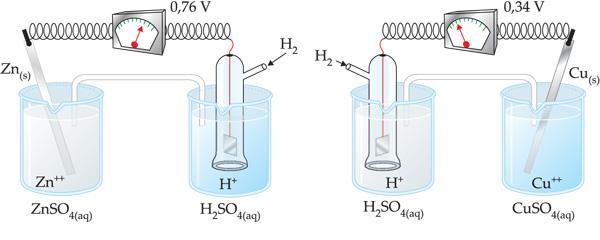
En caso de la pila formada por los electrodos de Zinc e Hidrógeno, la ddp registrada fue de 0,76 V. Con el funcionamiento de la pila, notamos que en el electrodo de Zinc sucede corrosión del Zn(s), donde concluimos que este sufre oxidación.
Así, o Ered del electrodo de Hidrógeno (Ered = cero) es mayor que el del electrodo de Zinc
Como:
El signo negativo indica que el electrodo de hidrógeno al cual fue atribuido un Ered = cero posee capacidad de atraer e– del electrodo de Zinc.
El ión H+(aq) es capaz de oxidar el zinc metálico, provocando su corrosión, por el hecho de poseer un Ered mayor que el Ered del electrodo de zinc.
En el caso de la pila formada por los electrodos de cobre e hidrógeno, la ddp registrada fue de 0,34 V. Con el funcionamiento de la pila, notamos que en el electrodo de cobre ocurrió deposición del metal en la placa, donde concluimos que hubo reducción del Ion, como muestra la ecuación:
Así, el E0red del electrodo de hidrógeno (E0red = cero) es menor que el del electrodo de cobre
Como:
El signo positivo indica que el electrodo de cobre posee un Ered mayor que el del electrodo de Hidrógeno, o sea, el Ion Cu2+ es capaz de oxidar el H2: H2 => 2H+ + 2e–
Como vemos en los ejemplos representados, el electrodo de hidrógeno puede ser el cátodo o el ánodo de una pila. Si combinamos el electrodo de Hidrógeno con electrodos de los más variados metales, notamos que algunos se comportan como el electrodo de cobre (E0red > 0), ya otros como el electrodo de Zinc E0red > 0.