Electrodeposición
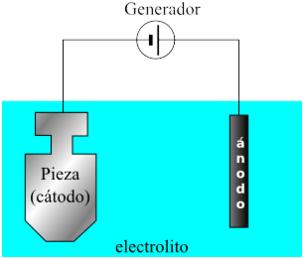
La electrodeposición es un procedimiento electroquímico mediante el cual se logra cubrir una pieza con una fina capa de determinado metal. Para lograrlo se sumerge la pieza a cubrir en una solución electrolítica que contiene los iones del metal que formará la capa.
La pieza se pondrá en contacto con una fuente de corriente continua y con un electrodo que cumplirá la función de ánodo, cediendo electrones para que los iones metálicos en solución se reduzcan y se depositen sobre la pieza, que cumple la función de cátodo. De esta manera se obtiene el recubrimiento metálico en la pieza.
Recordemos que el ánodo de este sistema estará hecho del metal con que se quiere recubrir la pieza, para que pueda disolverse, oxidarse, cediendo electrones y aportando iones a la solución, a medida que los iones que estaban presentes en la solución, se reducen y se depositan sobre la pieza a recubrir, que funciona como cátodo en el sistema. Todo este proceso es posible gracias a la corriente continua que permite la movilización de electrones.
Otro punto a destacar es que las propiedades que tendrá la capa que recubre la pieza, depende directamente de la corriente que se haya aplicado. La adherencia de la capa, su calidad, la velocidad de deposición, dependen del voltaje y de otros factores relacionados con la corriente aplicada.
También hay que tener en cuenta que si el objeto a recubrir tiene una superficie intrincada, la capa formada será más gruesa en algunos puntos y más fina en otros. De todos modos, existen maneras de eludir este inconveniente, por ejemplo, utilizando un ánodo con forma similar a la de la pieza a recubrir.
Este procedimiento es utilizado para brindarle resistencia a la corrosión a una determinada pieza, también para que aumente su resistencia a la abrasión, para mejorar su estética, entre otras funciones.
Una de las aplicaciones frecuentes de este procedimiento, es en la joyería, en donde una pieza realizada con un material barato, se recubre de una capa de oro o plata, para protegerla de la corrosión y para aumentar el valor de la pieza.
Incluso se logran recubrir piezas plásticas con capas metálicas, logrando que la pieza tenga las propiedades del metal, en su superficie.
La electrodeposición es uno de los procesos electroquímicos aplicado a nivel industrial, que tiene mayor importancia en cuanto a volumen de producción, y es también uno de los que causan mayor impacto económico, ya que se logra que piezas constituidas por material barato, tengas excelentes características de resistencia a la corrosión, gracias a la capa metálica electrodepositada. Algunos ejemplos son el zincado electrolítico, los procesos de estañado y cormado, entre otros.
Los electrodepósitos de aleaciones de zinc tienen frecuentemente mayor resistencia a la oxidación que los de zinc, y sustituyeron a los antiguos recubrimientos con cadmio, metal potencialmente tóxico.
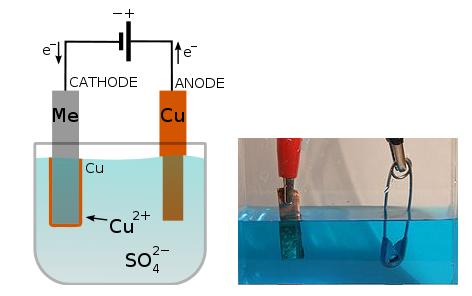
Un ejemplo de electrodeposición fácil de realizar en cualquier laboratorio, es la electrodeposición de cobre sobre un clip.
Sólo necesitamos un trozo de cobre, una solución de sulfato de cobre, un clip y una fuente de corriente continua. El dispositivo se armará como se ve en la figura de abajo.
El trozo de cobre actuará como ánodo, oxidándose para brindar iones cobre a la solución, mientras que los iones cobre de la solución se reducirán y se depositarán sobre el clip, que actuará como cátodo.