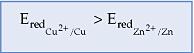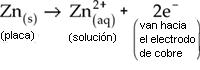Electroquímica y Pilas
Es el estudio de las reacciones en las que ocurre conversión de energía química en energía eléctrica y viceversa.
En una pila galvánica ocurre la conversión de energía química en energía eléctrica, ya en una electrolisis ocurre la conversión de energía eléctrica en energía química.
En electroquímica estudiamos las reacciones de óxido reducción que generan o consumen energía.
Pilas
La electroquímica estudia las soluciones electrolíticas y los fenómenos que ocurren cuando son colocados electrodos en estas soluciones. Básicamente, la electroquímica abarca el estudio de las pilas y de la electrolisis.
Utilizando los sistemas abajo, haremos algunas experiencias.
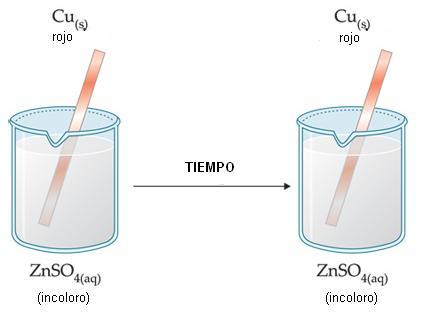
1a experiencia: Una lámina de Cu(s) es sumergida en una solución de ZnSO4(aq).
Cu(s) + ZnSO4(aq) → no ocurre reacción
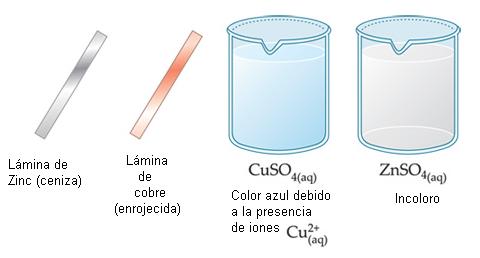
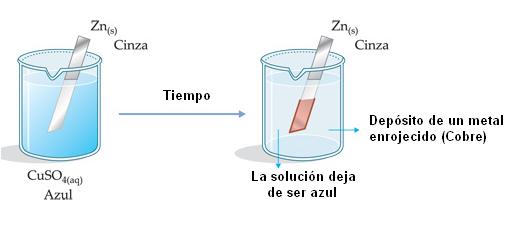
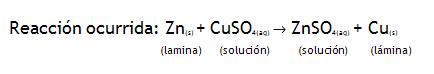
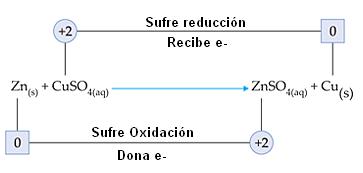
2a experiencia: Una lámina de Zn(s) es sumergida en una solución de CuSO4(aq).
Explicación:
– El ion Cu2+(aq) “arranca” e– del Zn(s), causando su oxidación;
– El ion Cu2+(aq) presenta capacidad de arrancar e– del Zn(s) (es una observación experimental).
Analizando las dos experiencias, concluimos que el íon Cu2+(aq) logra arrancar e– del Zn(s), ya el Ion Zn2+(aq) no logra arrancar e– del Cu(s).
Conclusiones
– El ion Cu2+(aq) posee mayor capacidad de atraer (arrancar) e– que el Ion Zn2+(aq)
– El Zn(s) posee mayor capacidad de donar e– que Cu(s)
Cada Ion metálico en solución presenta una diferente capacidad de atraer e–, y esta se llamará potencial de reducción (Ered).
Electrodo
Un electrodo (que en griego significa «camino para la electricidad») es formado por un metal, sumergido en una solución conteniendo cationes de ese metal.
Ejemplo
Condiciones para Conducción de la Corriente Eléctrica
– Una diferencia de potencial (ddp);
– Un medio conductor.
Como el electrodo de cobre (Cu2+/Cu) posee mayor potencial de reducción que el electrodo de zinc (Zn2+/Zn), podemos decir que entre los electrodos existe una ddp. Si entre esos electrodos intercalamos un hilo conductor, ahora tenemos condiciones para la conducción de la corriente eléctrica.
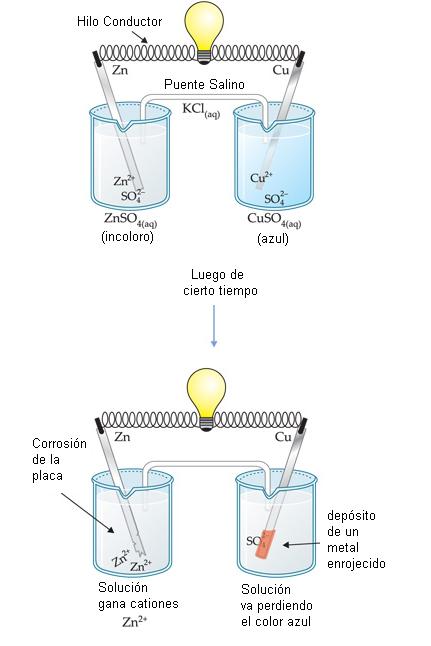
Pila de Daniel
Experiencia
Explicación
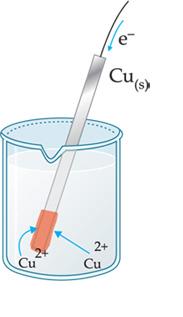
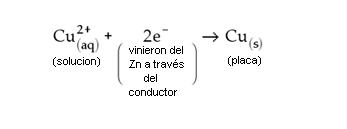
En el electrodo de cobre:
Iones Cu2+(aq) de la solución migran hasta la placa de cobre y receben los electrones cedidos por el Zn(s). Al recibir los electrones, se transforman en Cu(s), de acuerdo con la ecuación:
Observación: Como la concentración del Cu2+(aq) de la solución disminuye, la solución va perdiendo la coloración azul.
En el electrodo de zinc:
Al ceder electrones a través del conductor metálico para el ion Cu2+(aq) , debido a la ddp entre los dos electrodos, Zn(s) de la placa va para la solución en la forma de Zn2+(aq) , causando la corrosión de la placa y consiguiente aumento de la concentración de Zn2+(aq) en la solución, de acuerdo con la ecuación:
Así, debido a la ddp criada entre los dos electrodos, observamos que existe un movimiento ordenado de cargas en el hilo conductor, o sea, una corriente eléctrica. Tal hecho queda evidenciado por la lámpara que asciende cuando la pila es accionada.
Por lo tanto, pilas son sistemas que poseen capacidad de producir energía eléctrica a partir de una reacción química. Estos sistemas pueden ser llamados también de células galvánicas. Una célula galvánica, o simplemente pila, transforma la energía de una reacción química en energía eléctrica.