Celda electroquímica
La Electroquímica es una rama de la química que estudia las reacciones químicas que ocurren en una solución que implica a conductor (un metal o un semiconductor) y un conductor iónico (el electrolito), para el intercambio de electrones entre el electrodo y el electrolito.
Este campo científico abarca todos los procesos químicos que suponen una transferencia de electrones entre las especies, por lo que la transformación de energía química en energía eléctrica. Cuando se produce este proceso, produciendo la transferencia de electrones, produciendo espontáneamente una corriente eléctrica cuando se conecta a un circuito eléctrico, producción o diferencia de potencial entre dos polos, se llama celda o la batería (que consiste a menudo en varias células). Cuando este proceso se proporciona, inducida por la acción de una corriente eléctrica de una fuente externa, este proceso se llama electrólisis.
Historia
La primera célula electroquímica fue creado en 1800 por Alessandro Volta , quien utilizó los discos (llamados electrodos) de la alternancia de cobre y cinc , separados por el algodón empapado en una solución salina . El nombre de «batería» proviene de la superposición de discos de metal y algodón.
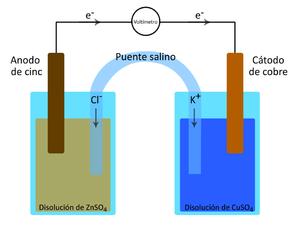
John Frederic Daniell , en 1836, construyó una celda con electrodos de cobre y zinc, pero cada electrodo se encontraba en una celda individual, con un tubo llamado «puente de sal» que conecta los dos tanques, aumentando su eficiencia . Este tipo de dispositivo que se conoce como la celda de Daniell.
Descripción
Los elementos que intervienen en una reacción electroquímica se caracterizan por el número de electrones que tienen. El número de oxidación de un ion es el número de electrones que ha aceptado o donado en comparación a su estado neutral (que se define como el número de oxidación igual a cero). Si un átomo o ion dona electrones en una reacción aumenta su número de oxidación, que acepta un electrón su pérdida disminuye. A número de electrones de una sustancia que se llama oxidación, y la ganancia que se conoce como reducción.
Una reacción en la que se producen se llama oxidación y la reacción de reducción redox.
Para ser considerado como una reacción electroquímica que implican el paso de corriente eléctrica en una distancia finita mayor que la distancia interatómica.
Una reacción electroquímica es una reacción redox que se produce con el paso simultáneo de la corriente entre dos electrodos.
La corriente que fluye en la reacción puede tener dos orígenes:
En el mismo centro, a continuación, cuando se tiene una celda electroquímica.
Generado por una fuente de energía exterior, cuando se tiene una celda electrolítica
En ambos casos, siempre hay dos electrodos:
Ánodo: electrodo donde se enfrentan a los aniones, o, alternativamente, donde forman cationes. Esto siempre pasa del electrodo a la corrosión, con la consiguiente pérdida de la masa, y siempre se produce la oxidación de los aniones, o bien la formación de los cationes del metal del electrodo (cuando también tiene una oxidación).
Cátodo: electrodo donde se enfrentan a los cationes. En este electrodo se produce cada depósito, y también la reducción de cationes.