Enlace Pi
El enlace pi (π) es un enlace covalente formado por la hibridación de dos orbitales atómicos p. Los orbitales d también pueden participar en este tipo de enlace.
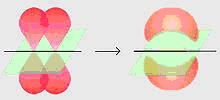
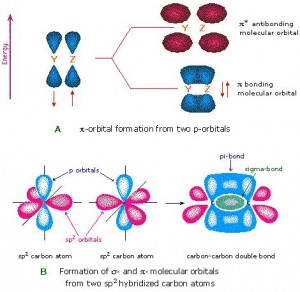
En la figura de arriba observamos dos orbitales p formando un enlace π.
Este tipo de enlace no posee tanta energía como el enlace sigma, dado que los electrones que los forman se encuentran más alejados del núcleo, y por eso la fuerza de atracción entre los electrones y el núcleo es menor. Desde el punto de vista de la mecánica cuántica, este fenómeno se puede explicar por el grado menor de traslape de los orbitales p para formar el enlace π, dada la orientación en paralelo de los mismos.
De todas maneras, es frecuente encontrar enlaces π, sobre todo en enlaces dobles o múltiples. Cuando a un enlace sigma entre dos núcleos, se agrega un enlace π, la fuerza del enlace se incrementa, disminuyendo la longitud del mismo. Por ejemplo, la longitud de un enlace simple (sigma) entre dos átomos de carbono, en el etano, es de 154 picómetros. En cambio, en el etileno, donde al enlace sigma entre carbonos se agrega el enlace π, la longitud entre los núcleos disminuye a 133 picómetros.
Para comprender mejor los enlaces sigma y pi en el enlace covalente, debemos primero entender cómo se hibridan en el espacio los orbitales atómicos s y p. Observando los orbitales s y p desde un punto de vista tridimensional, podemos distinguir tres orientaciones espaciales de los tres lóbulos del orbital p: 2px, 2py & 2pz. Cada uno de estos lóbulos lleva dos electrones, haciendo un total de 6 electrones para el orbital p.
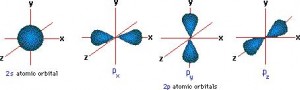
Si ponemos por ejemplo el átomo de carbono, sus electrones de valencia se disponen de la siguiente manera en estos orbitales: 2s2, 2px1, 2py1 & 2pz0.
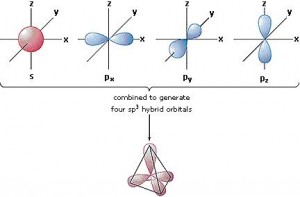
De esta manera, podría pensarse que el carbono sólo puede formar dos enlaces, dado sus dos electrones libres en los orbitales p. Sin embargo el carbono forma muy frecuentemente cuatro enlaces. Esto se debe a que en realidad los orbitales s y p se hibridan en el espacio, formando cuatro orbitales sp3 que se disponen naturalmente en forma de tetraedro, y todos tienen la misma tendencia para formar enlaces.
En el caso de enlaces dobles entre carbono y carbono, el orbital s de cada carbono está hibridado con sólo dos de los lóbulos del orbital p, dejando un lóbulo libre. Los orbitales híbridos sp2 de los carbonos forman un enlace sigma, mientras que los lóbulos restantes del orbital p forman el enlace pi, quedando así constituido el doble enlace.
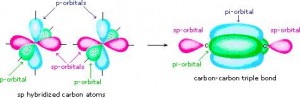
Cuando el enlace entre carbonos es triple, hay dos lóbulos del orbital p sin hibridar. El enlace sigma se da entre los orbitales hibridados sp, y los dos lóbulos restantes del orbital p forman dos enlaces pi, en dos planos perpendiculares, como se ve en la siguiente figura: