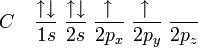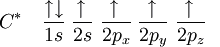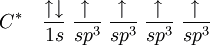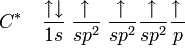Hibridación
Hibridación, es el proceso de formación de orbitales electrónicos híbridos. En algunos átomos, los orbitales de los subniveles atómicos s y p mezclarse, dando origen a orbitales híbridos sp, sp² e sp³.
Según la teoría de los enlaces covalentes, un enlace de este tipo se efectúa por la superposición de orbitales semi llenados (apenas con un electrón).
La hibridación explica la formación de algunos enlaces que serían imposibles por las teorías asociadas, así como la disposición geométrica de algunas moléculas.
Elementos posibles de hibridar
Los elementos que se hibridan son el carbono, silicio, azufre, (…). El oxígeno y el nitrógeno también se hibridan, sin embargo, sin activación.
Formas de hibridación
Hibridación sp3
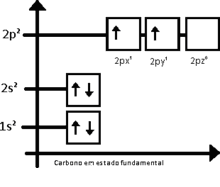
La hibridación sp3 es fácilmente explicada por el carbono. Para el carbono tetraédrico (como en el metano, CH4), debe haber cuatro enlaces simples. El problema es que la distribución electrónica del carbono en estado fundamental es 1s2 2s2 2px 2py, esquematizando lo que sucede tenemos:
El orbital 1s tiene menos energía que el 2s, que a su vez, tiene menos energía que los orbitales 2p
De esta forma, el carbono debería realizar apenas dos enlaces, por lo que existen apenas dos orbitales semi llenados. En tanto, la molécula de metileno (CH2) es extremadamente reactivo, no estando equilibrado químicamente. El primer paso para entender el proceso de hibridación, es excitar el átomo de carbono en cuestión, teniendo entonces:
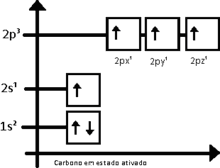
Distribución electrónica del carbono activado
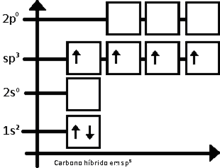
Entonces, el carbono equilibra los cuatro orbitales, dando origen a orbitales de energía intermediaria entre 2s y 2p, dando origen al orbital sp3 (que se lee s-p-tres), así llamado por ser el resultado de la fusión de un orbital s con tres orbitales p. Por tanto se tiene:
Distribución electrónica del carbono híbrido en sp3
Hibridación sp2
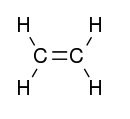
Otras formas de hibridación son explicadas de forma semejante a sp3 del metano. La hibridación sp2 es realizada cuando uno de los orbitales p no se hibrida. Esto sucede en moléculas como la de Eteno, en la cual existe un enlace doble entre carbonos. La estructura de Lewis de esta molécula es algo parecido con:
No son todos los orbitales que se hibridan, pues los orbitales híbridos forman apenas enlaces sigma y un enlace pi y es necesaria para el enlace doble entre los carbonos. Su distribución electrónica quedará algo como lo que se ve en las moléculas tetraédricas, trigonal, plana y linear plana (109º,28’) (120º) (180º).
Enlace Sigma: Es un enlace entre dos orbitales atómicos. El enlace sigma puede ser dada como el enlace entre dos orbitales s, o entre un orbital s y un p, o aún entre dos orbitales p, donde en todos estos casos, los orbitales se interpenetran frontalmente.
Enlace Pi: En química orgánica, enlaces pi (o enlaces π) son enlaces químicos covalentes en los cuales dos lóbulos de un orbital electrónico interseccionan dos lóbulos de otros orbitales electrónicos. Apenas uno de los planos nodales de aquel orbital pasa por los núcleos involucrados en el enlace. Es el enlace característico de compuestos con dobles o triples enlaces como es el caso del propeno y el etino.