Aconitina
En los tubérculos Del Aconitum napellus L. se encuentran diversos elementos constituyentes, tales como glúcidos variados, resina, ácidos orgánicos, taninos, compuestos aminados y cerca de 0,5 a 1,5% de alcaloides bajo la forma de sales, particularmente del ácido acónico.
Los alcaloides presentes en A.napellus L. se caracterizan por ser biogenéticamente derivados de un terpenoide diterpénico el cual en una fase posterior, se incorpora uno o más átomos de azufre.
Poseen una estructura bastante compleja presentando un esqueleto con 16 o 17 átomos de carbono enlazando una estructura aminada.
El tenor en alcaloides puede variar conforme El ciclo vegetativo y el origen geográfico.
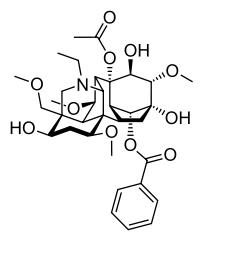
Aconitina – (C34H47NO11, PM=645,75)
La aconitina (acetilbenzoilaconina) es uno de los alcaloides más venenosos que se conocen. Es el alcaloide más abundante del A.napellus L. (99% de alcaloides totales) y sus propiedades farmacológicas y medicinales son conocidas desde 1833. Es un diester formado por ácido acético y ácido benzoico y por la base aconina (alcamina nor-diterpénica penta-hidroxilada). Es sumamente tóxica y su dosis letal para un adulto se ubica entre 3 y 6 mg.
Aconitina1.jpg
La aconitina actúa como un veneno muy rápido, causando un ablandamiento del ritmo cardíaco y una disminución de la presión sanguínea. La absorción a través de la piel puede ser fatal y las floristas que manipulan el A.napellus L. pueden sufrir envenenamiento.
La aconitina se cristaliza en prismas y más frecuentemente en láminas derivadas de un prisma romboidal y sus cristales son anhidros.
Se funde a 194º, es incolora e inodora.
El cloroformo se disuelve en abundancia; es igualmente soluble en benceno. Es dextrógira en solución de alcohol absoluto y levógiro en solución de benceno. La aconitina presenta reacción ligeramente alcalina.
Es una base débil que forma durante sales bien cristalizadas, cuya principal es el nitrato de aconitina.
Por ebullición prolongada fija agua y se desdobla en ácido acético y banzoilaconina que se deposita por enfriamiento. Este desdoblamiento ocurre inclusive a temperatura ambiente, tanto en solución acuosa como en solución de alcohol a 70º, de tal forma que la tintura o alcoholaturo de acónito, así como el extracto de acónito, pierden poco a poco su actividad fisiológica.
Por este motivo el ensayo biológico es indispensable.
La hidrólisis total de la aconitina ocurre en 150º, o al frío en medio alcalino, conduciendo en productos desprovistos de actividad y toxicidad. La ecuación de desdoblamiento es la siguiente:
| C34H47NO11 + | 2H2O | ===> | CH3CO2H+ | C6H5CO2H | + C25H41O9N |
| Aconitina | Ácido Acético | Ac. Benzoico | Aconina |
Hipaconitina (C33H45NO10, PM=615,72)
La hipaconitina cuya fórmula se traduce en 3-desoximesaconitina, japaconitina B1, japaconitina C1, es el resultado de la conversión de la aconitina por vía de un intermediario llamao desoxiaconitina. Es un veneno potente de forma semejante al inducido por la aconitina.
Mesaconitina (C33H45NO11, PM=631,72)
La mesaconitina cuya fórmula se traduce como 3a-hidroxi-hipaconitina fue aislada por primera vez en 1929. Difiere de la aconitina apenas porque posee un grupo N-metil en vez de un grupo N-etil. Es un alcohol muy potente y posee una actividad semejante a la aconitina.
Napelina (C22H33NO3, PM=359,51)
La napelina cuya fórmula se traduce como lucicolina, napelana, es también un alcaloide diperténico. Posee efecto en el sistema cardiovascular, que se manifiesta en un descenso de la presión arterial y produce también disturbios respiratorios.
Lapaconitina (C32H44N2O8)
La lapaconitina es también uno de los alcaloides presentes en el acónito. Posee un grupo benzol en el C18, al contrario de la aconitina que posee este grupo en su C14. A pesar de la semejanza estructural, se piensa que la lapaconitina posea acción diferente a la de la aconitina, ya que parece ser un bloqueante de los canales de sodio dependientes de voltaje y no un agonista.
La lapaconitina presenta acción anti-epileptiforme y además de eso demostró en estudios la inducción a la bradicardia en preparaciones con células cardíacas, sugiriendo entonces sus propiedades anestésicas locales de Clase 1.