Teoría corpuscular de la luz de Einstein
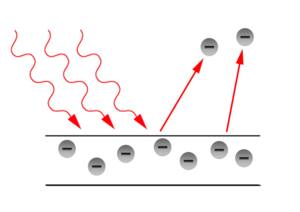
El físico alemán, Heinrich Rudolf Hertz descubrió, en 1887 el efecto fotoeléctrico, cuando vio que un material cargado, pierde su carga de manera sencilla cuando se le somete a una luz ultravioleta.
Dicho fenómeno fue explicado más adelante por Albert Einstein, el cual comprobó que efectivamente, determinados metales eran capaces de emitir electrones cuando se los exponía a la luz.
Las características del fenómeno eran:
- Los metales emitían electrones siempre y cuando la radiación alcanzase una frecuencia mínima, a la que se llamó, frecuencia umbral.
- Cuando aumentaba la intensidad de la luz, pero no variaba la frecuencia, aumentaba también el número de electrones que se emitían desde el metal, pero no variaba la energía con la cual eran emitidos.
- Si la frecuencia no llegaba al valor de la frecuencia umbral, no se emitían electrones, independientemente de la intensidad de la radiación.
La explicación de este fenómeno fue realizada en 1905, por el físico alemán Albert Einstein, que se encontraba influenciado por la hipótesis cuántica de la energía, que años antes había presentado M. Planck.
La teoría de Einstein afirmaba que:
La luz está formada o constituida por partículas, conocidas como fotones, cuya energía viene dada por la ecuación: E= h. υ, donde υ representa a la frecuencia de la luz que se emplee en cada caso.
De esta manera, Einstein puede dar explicación a las características que dan definición al efecto fotoeléctrico:
- Los electrones son desprendidos del metal, cuando a estos se les comunica la energía necesaria para poder liberarse de la energía de atracción que ejerce el núcleo. Si la energía que se comunica al electrón, es menor, no se producirá efecto fotoeléctrico alguno. En cambio, si es mayor, el electrón sale despedido con una determinada energía cinética. La energía mínima que se necesita para que se produzca el efecto fotoeléctrico se llama, energía umbral.
- La energía umbral, corresponde a un fotón con una determinada frecuencia, la frecuencia umbral, que viene representada por υ0. La energía de los fotones, E= h. υ, que chocan con el electrón es mayor que la energía umbral, E= h. υ0, produciendo el efecto fotoeléctrico, donde el electrón sale despedido con la energía cinética, Ec, que corresponde a la siguiente ecuación:
h υ= h.υ0 + Ec
- La intensidad de la luz, debe comprenderse como una medida de la cantidad de fotones por unidad de tiempo.
Por lo tanto, si incrementa, se aumentará el número de electrones que emitirá el metal, pero sólo si la frecuencia de la radiación llega al valor umbral; en cambio, en el caso contrario, la energía de los fotones es insuficiente como para provocar el efecto fotoeléctrico, independientemente de cual sea la intensidad de la radiación.
Cuando una placa de metal se ilumina con cierta intensidad decimos que absorbe una energía en la unidad de tiempo proporcional, así pues, basta dividir dicha energía por la cantidad h. υ, para poder obtener la cantidad de fotones que chocan sobre la placa por unidad de tiempo.
Debido a que cada electrón que se emite, adquiere una energía de un único fotón, se llega a la conclusión, de que el número de electrones que se emiten por unidad de tiempo es proporcional a la intensidad de la luz que incide sobre la placa metálica.