Regla del Octeto
La regla del octeto establece que los átomos de los elementos se enlazan unos a otros en el intento de completar su capa de valencia (ultima capa de la electrosfera).
La denominación “regla del octeto” surgió en razón de la cantidad establecida de electrones para la estabilidad de un elemento, o sea, el átomo queda estable cuando presenta en su capa de valencia 8 electrones.
Para alcanzar tal estabilidad sugerida por la regla del octeto, cada elemento precisa ganar o perder (compartir) electrones en los enlaces químicos, de esa forma ellos adquieren ocho electrones en la capa de valencia.
Por ejemplo tenemos:
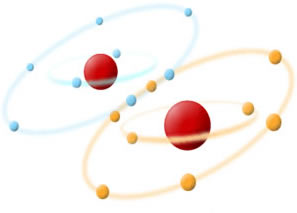
Veamos que los átomos de oxígeno se enlazan para alcanzar la estabilidad sugerida por la regla del octeto. Los diferentes colores de electrosfera mostrados en la figura nos ayudan a interpretar lo siguiente:
1 – Átomos de Oxigeno poseen seis electrones en la capa de valencia (anillo externo en la figura)
2 – Para volverse estables precisan contar con ocho electrones. ¿Y como lo logran entonces?
Comparten dos electrones (indicado en la unión de los dos anillos), formando una molécula de gas oxígeno (O2)
La justificativa para esta regla es que las moléculas o iones, tienden a ser más estables cuando la capa de electrones externa de cada uno de sus átomos está llena con ocho electrones (configuración de un gas noble).
Es por ello que los elementos tienden siempre a formar enlaces en la busqueda de tal estabilidad.
Excepciones a la regla del Octeto
Berilio (Be)
Es una excepción a la regla del Octeto porque es capaz de formar compuestos con dos enlaces simples, siendo así, se estabiliza con apenas cuatro electrones en la capa de valencia.
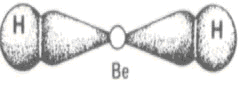
Como el hidrógeno (H) precisa ceder dos electrones para realizar el enlace (H ― Be ― H), el átomo de Berilio (Be) comparte sus electrones y alcanza la estabilidad.
Aluminio (Al)
Es una excepción a la regla del octeto porque alcanza la estabilidad con seis electrones en la capa de valencia. El átomo de aluminio tiende a donar sus electrones y así puede formar tres enlaces simples con otros átomos
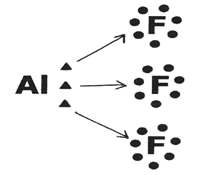
En este caso, el Aluminio (Al) formó tres enlaces con tres átomos de Fluor (F)
Boro (B)
Forma sustancias moleculares con tres enlaces simples.
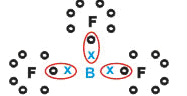
Fijémonos que el Boro (B) tiene la tendencia de donar sus electrones para los átomos de Flúor (F), este si obedece a la regla del Octeto, necesitando sus ocho electrones en la capa de valencia. Como el Boro cede sus electrones, el Flúor se estabiliza con el Octeto formado.
