El Ácido nítrico
El ácido nítrico, también conocido como nitrato de hidrógeno, es un líquido altamente corrosivo y tóxico, en contacto con la piel puede ocasionar quemaduras graves.
El ácido nítrico puro es incoloro, si contiene algunas impurezas puede tornarse ligeramente amarillo. A temperatura ambiente libera humos blancos o amarillos.
Tiene diversas aplicaciones industriales, es usado para fabricar explosivos, como el TNT (trinitrotolueno), también se utiliza en la fabricación de fertilizantes, como el nitrato de amonio. El ácido nítrico es muy reactivo, por eso es utilizado también en la industria metalúrgica, ya que es capaz de reaccionar con la mayoría de los metales. Sin embargo, no oxida el oro ni el platino. Si combinamos una parte de ácido nítrico con tres partes de ácido clorhídrico, obtenemos un compuesto llamado “agua regia”, que sí es capaz de atacar estos metales.
El ácido nítrico se puede obtener a partir de pentóxido de dinitrógeno (N2O5) y agua. El ácido nítrico forma un azeótropo con agua, cuando se encuentran en proporciones de 68% de acido nítrico y 32% de agua. Esto significa que agua y ácido nítrico en estas proporciones, se comportan como si fueran un único compuesto, con un único punto de ebullición.
También se puede obtener ácido nítrico a partir de amoníaco y oxígeno. Esta síntesis se realiza a nivel industrial, dado que es necesaria la utilización de un reactor de gran tamaño. La reacción es catalizada por medio de un metal como platino o rodio.
Las soluciones comerciales de ácido nítrico tienen una concentración entre el 52% y el 68%. Las soluciones con mayor pureza se denominan ácido nítrico fumante, existiendo dos variedades, rojo y blanco.
En contacto con proteínas, el ácido nítrico reacciona dando lugar a compuestos de color amarillo fuerte, esta reacción es llamada “xantoproteica”.
Características químicas
El ácido nítrico tiene gran potencia oxidante, algunas de sus reacciones pueden ser violentas, o incluso explosivas. Es un ácido fuerte, disuelto en agua se disocia por completo.
Su fórmula química es HNO3.
En las figuras que siguen observamos su estructura:
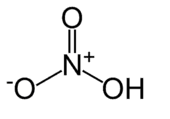
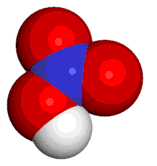
Acido nítrico.
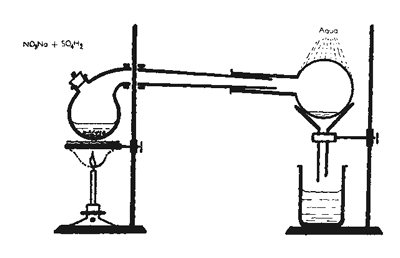
Se puede obtener ácido nítrico en cualquier laboratorio, a partir de nitrato de sodio y ácido sulfúrico.
NaNO3 + H2SO4 NaHSO4 + HNO3
Esta reacción en reversible a temperatura ambiente, pero si brindamos calor a la reacción, el ácido nítrico se evapora y el equilibrio se desplaza hacia la derecha. Los vapores son condensados por medio de agua fría, y recolectados en recipientes de material resistente al ácido.