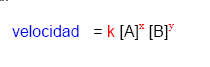Ecuación Cinética
La Cinética Química es la disciplina de la química que estudia las velocidades con las que ocurren las reacciones química. Así cinética química corresponde a la velocidad de una reacción, o sea, la variación temporal de concentración de un reactivo.
Una reacción genérica del tipo Reactivo —- Producto, puede ser esquematizada de la siguiente forma:
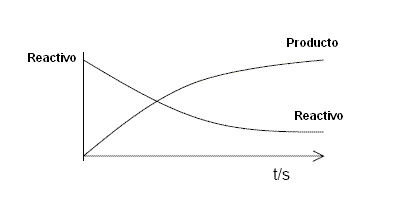
La velocidad media de una reacción puede definirse como la alteración de la concentración de un reactivo en un dado intervalo de tiempo. Sin embargo puede también usarse la alteración de color y otra propiedad física o química para ayudar a determinar la velocidad
Ecuación Cinética o Ley de la Velocidad de Reacción
Esta determinación es siempre realizada experimentalmente analizándose, normalmente, la variación de propiedades en el instante inicial.
Una reacción química genérica del tipo aA + bB — > cC + dD tiene una ecuación cinética de la forma:
x e y son los ordenes parciales de la reacción y su suma corresponde al orden global de la reacción. De notar que el orden de una reacción es definido en relación a las concentraciones de los reactivos y no de los productos.
Vamos a analizar ahora como se determina la ley de la velocidad de una reacción a partir de un conjunto de datos experimentales:
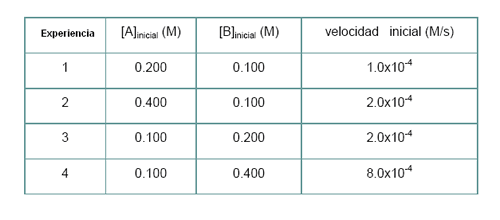
Del conjunto de resultados puede constatarse que cuando la concentración de A se duplica, manteniéndose constante la concentración de B, la velocidad duplica, por lo que la reacción es de primer orden en relación a A.
Por otro lado, cuando la concentración de A se mantiene constante y la de B se duplica, la velocidad cuadriplica, siendo la reacción de segundo orden en relación a B.
Otra forma de llegar a la misma conclusión es a través del uso de la ley de las velocidades.
Así considerando las experiencias 1 y 2 (concentración de B constante) las expresiones de la ley de las velocidades son:
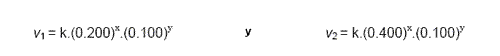
Relacionando las dos expresiones de modo a tener v1/v2 y sustituyendo los valores de v1 y v2 nos quedamos con:
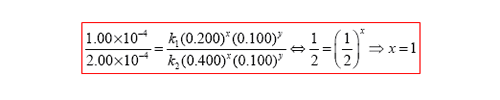
De notar que k1 y k2 son iguales por lo que se cancelan en la expresión pasada. De aquí se concluye que la reacción es de primer orden en relación a A.
Para el reactivo B, el procedimiento es idéntico:
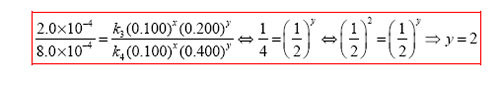
Por lo que la reacción es de segundo orden relativamente a B. Así la ley de las velocidades o ecuación cinética para esta reacción será escrita de esta forma:
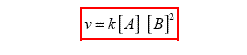
El orden global de la reacción es 1 + 2 = 3
Para determinarse la constante de velocidad de la reacción basta hacer los cálculos para cualquier una de las experiencias. Así, como ejemplo presentamos el cálculo de k para la experiencia 3.
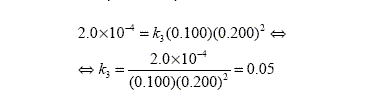
Si por ventura tuviésemos una reacción del tipo aA + bB + cC — > Productos con un conjunto de resultados como los siguientes:
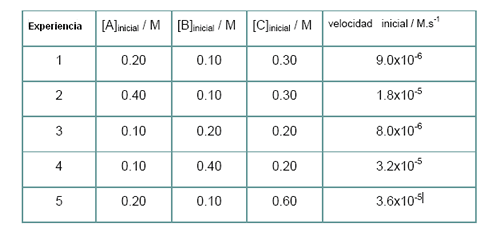
En este ejemplo se consideran conjuntos de dos reactivos con concentración constante, efectuándose el cálculo para el otro. Así:
Concentraciones de B y C constantes (experiencias 1 y 2): el análisis de este caso muestra que la concentración duplica y que la velocidad también lo hace; la reacción es de primer orden en relación a A.
Concentraciones de A y C constantes (experiencias 3 y 4): en este caso, se verifica que la concentración de B duplica y la velocidad cuadriplica; el orden de la reacción en relación a B es dos.
Concentraciones de A y B constantes (experiencias 1 y 5): se verifica, igualmente que la concentración de C duplica y que la velocidad cuadriplica; reacción de segundo orden en relación a C.
Si efectuásemos el cálculo de los órdenes de las reacciones recurriendo a las leyes de velocidad se verifican las mismas conclusiones. Se presentan esas expresiones ya simplificadas.

La ecuación cinética entonces resulta:
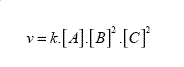
El orden global de esta reacción es: 1+2+2=5
El cálculo de la constante de velocidad, k, se hace recorriendo los datos de cualquiera de las experiencias.