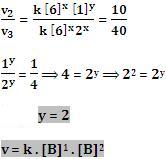Cinética Química
La cinética química estudia la velocidad de las reacciónes químicas, así como los factores que pueden modificarlas.
Consideremos la reacción
1N2(g) + 3H2(g) 2NH3(g)
La Cinética, o Vm puede ser calculada considerando [ ] (variación de la concentración molar en módulo):
Vm aplicada al consumo de
Vm en consumo ![]() == > velocidad media de consumo de N2
== > velocidad media de consumo de N2
Vm en consumo ![]() == > velocidad media del consumo de H2.
== > velocidad media del consumo de H2.
Vm para la producción 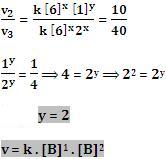 == > velocidad media de producción de NH3.
== > velocidad media de producción de NH3.
Unidad: ![]()
Para la velocidad media de la reacción tenemos:
![]()
Observación: Para calcular la velocidad media de reacción, basta dividir la velocidad de uno de los participantes por su propio coeficiente.
Aplicación:
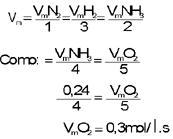
La combustión del amoníaco está representada por la ecuación química:
4NH3(s) + 5O2(g) 4NO(g) + 6H2O(g)
Se midió la velocidad de la reacción en determinado momento y se observó que el amoníaco estaba siendo quemado en una velocidad de 0,24 mol/ls. Cual será la velocidad de consumo del gas oxígeno.
Solución:
Condiciones para que una reacción suceda
1. Afinidad química; los reactivos deben tener tendencia a entrar en reacción
2. Contacto entre los reactivos; a fin de que pueda existir interacción química
3. Choque efectivo y bien orientado
Clasificación de las reacciones en cuanto a la velocidad
Reacciones Instantáneas
Son aquellas reacciones que ocurren en una velocidad muy elevada, dificultando su determinación. Como ejemplo, podemos citar las reacciones explosivas, reacciones de precipitación, reacciones de neutralización de ácido por base, entre otras
![]()
Reacciones Lentas
Son las reacciones que suceden en una velocidad muy baja
Ejemplo:
![]()
(en condiciones ambiente, sin la presencia de factores externos)
Reacciones moderadas
Son aquellas reacciones que ocurren en una velocidad intermedia. La cinética química se interesa principalmente por este tipo de reacción, pues su velocidad puede ser medida con exactitud.
Ejemplo:
Reacciones de metales, no muy reactivos, con ácidos:
![]()
Normalmente, las reacciones entre compuestos inorgánicos son rápidas y las reacciones entre compuestos orgánicos son lentas.
Dependencia de la velocidad de reacción con la energía de activación
La energía de activación puede ser definida como una barrera energética que impide la concreción de la reacción. La reacción solo ocurre cuando esa barrera ha sido superada.
Por tanto, cuanto mayor es la energía de activación, más difícil será que suceda la reacción.
Así, las reacciones lentas necesitan de gran cantidad de energía para suceder.
Y cuanto menor es la energía de activación, más fácil será que suceda la reacción.
De esta forma, las reacciones rápidas necesitan de poca energía para suceder.
Determinación experimental de la ecuación de la velocidad de reacción
Para elegir una ecuación matemática que representa la variación de la velocidad de reacción con la concentración de los reactivos, debemos basarnos apenas en los datos experimentales.
Ejemplo:
![]()
Podemos observar en la tabla a continuación, la variación de la velocidad con las concentraciones obtenidas por experiencia:
| A (mol / l) | B (mol / l) | Velocidad de reacción (mol) | |
| 1º experimento | 3 | 1 | 5 |
| 2º experimento | 6 | 1 | 10 |
| 3º experimento | 6 | 2 | 40 |
Para determinar, experimentalmente, la ecuación de la velocidad, debemos variar la concentración molar de los reactivos y verificar como varía la velocidad.
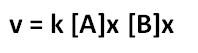
Siendo que x e y serán definidos. Dos métodos pueden ser utilizados:
Método comparativo
Al comparar el primer y segundo experimento, podemos darnos cuenta que la concentración de A se duplicó y consecuentemente la velocidad también lo hizo.
Al comparar el 2º y 3º experimento, notamos que la concentración de A permaneció constante, ya la concentración de B duplicó y consecuentemente la velocidad cuadriplicó.
Concluimos entonces que la velocidad varía con la 1º potencia de [A] y con la 2º potencia de [B]
![]()
Método Algebraico
Inicialmente dividimos v1 entre v2:
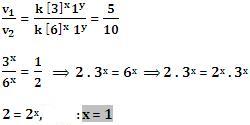
A continuación dividimos v2 entre v3