Catálisis Homogénea
En un perfil de reacción las moléculas siguen el camino que ofrece menor resistencia, aunque para hacer este camino ellas tengan que gastar una gran cantidad de energía.
Una elevada energía de activación para una relación, hace con que ella ocurra lentamente. El suceder de una relación química puede se modificada por la adición de compuestos no reactivos a la mezcla reactiva.
Estos compuestos tienen la función de alterar el camino de la reacción de modo que halla una disminución en la energía necesaria para que esto ocurra. Un material capaz de disminuir la energía de activación de una reacción es llamado catalizador.
Un catalizador actúa bajando la energía de activación, permitiendo que la reacción ocurra por un nuevo camino.
Entre millares de ejemplos que involucran la acción de catalizadores, se pueden citar las enzimas, que actúan en procesos metabólicos y el conversor catalítico, presente en los automóviles, capaz de reducir la emisión de poluyentes atmosféricos.
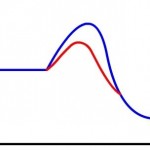
La curva azul de la figura representa una reacción sin catalizador y la roja una reacción con el uso de un catalizador.
Los catalizadores pueden ser homogéneos o heterogéneos. Una catálisis homogénea ocurre cuando catalizador y reactivos constituyen una sola fase (una solución). Catálisis heterogénea es aquella en la cual catalizador y reactivos constituyen dos o más fases (sistema polifásico o mezcla heterogénea).
Como toda reacción, las de catálisis tamben pueden ser descritas por un mecanismos. El mecanismo de actuación de un catalizador es una hipótesis basada en resultados obtenidos experimentalmente.
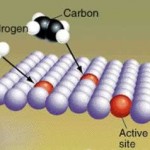
La figura aquí nos muestra un mecanismo propuesto para el efecto de un catalizador en la reacción de hidrogenación del etileno (C2H2)
Los catalizadores se asocian con las moléculas reactivas (también conocidas como sustratos) y provocan una redistribución de sus nubes electrónicas. Esto causa un adelgazamiento en los enlaces que deben ser rotos para que la reacción ocurra.
Cuando el producto es formado, el lugar meta es liberado y se vuelve capaz de repetir todo el proceso con otra molécula de reactivos.
Esta es una ventaja que los catalizadores heterogéneos presentan en relación a los catalizadores homogéneos. Los catalizadores heterogéneos pueden ser fácilmente separados (por filtración, por ejemplo) del medio reactivo y reutilizado diversas veces.
Si un aumento en la temperatura hace con que las reacciones ocurran con velocidades mayores, ¿para que utilizar un catalizador entonces?
No siempre un aumento en la temperatura de una reacción es práctico. Por ejemplo aumentando la temperatura de una reacción exotérmica puede ocurrir un cambio en el rendimiento del producto. En otros casos, temperaturas elevadas causan la descomposición de los productos, además de provocar reacciones indeseables.
En tales circunstancias, el uso de un catalizador es altamente recomendable.
Observación muy importante
A pesar de acelerar las reacciones químicas, los catalizadores no alteran la posición de equilibrio de una reacción química. Esto significa que la energía de los productos obtenidos es la misma en una reacción catalizada y en una no catalizada.