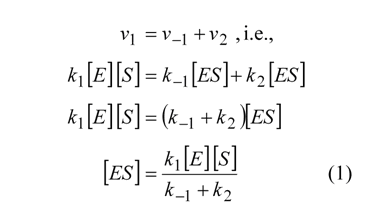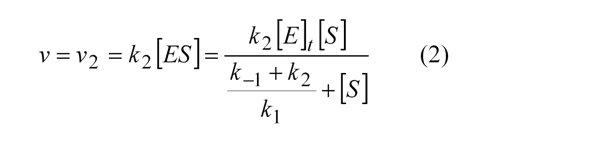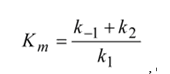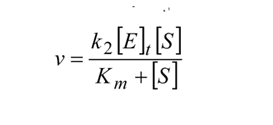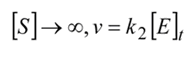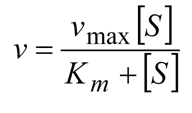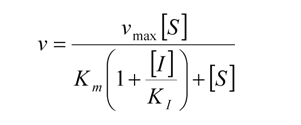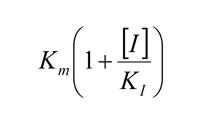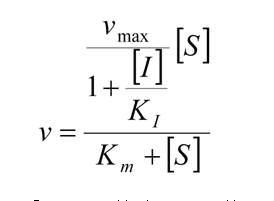Catálisis enzimática
Existen moléculas biológicas capaces de aumentar bastante la velocidad de reacciones químicas, i.e., son los llamados catalizadores. Estas moléculas son genéricamente denominadas “enzimas” y son (en casi su totalidad) proteínas. Las enzimas no proteicas conocidas son constituidas por RNA. Las enzimas son altamente específicas: cada enzima apenas reacciona con un conjunto muy restringido de moléculas (“sus sustratos”). Las enzimas no alteran el equilibrio químico de las reacciones catalizadas, apenas disminuyen su energía de activación.
El mecanismo más simple para explicar la acción enzimática es el modelo de Michaelis-Menten:
E +S <—-> ES —-> E + P
En este modelo la enzima (E) se liga al sustrato (S) para formar un complejo enzima-sustrato (ES). Este puede separarse nuevamente en enzima y sustrato libre o transformar el sustrato en producto (P). Como en cualquier reacción elemental (i.e. una reacción que ocurre por simple colisión entre reactivos), la velocidad de cada paso será proporcional a la concentración de los reactivos de ese paso. En cada caso, la constante de proporcionalidad será una función de la energía de activación de ese paso.
En la mayor parte de las enzimas se verifica que el equilibrio E +S <—-> ES se alcanza muy rápidamente (en pocas decenas de milisegundos). Una vez alcanzado el equilibrio, la concentración de ES se mantiene constante, una vez que siempre que un complejo ES se disocia en producto y enzima libre, esta se liga muy rápidamente a una nueva molécula de sustrato regenerando el complejo ES. En estas condiciones es obvio que la velocidad de degradación ES es igual a la velocidad de su formación o sea:
En principio, no nos es dado saber en cada momento cual será la concentración de enzima que se encuentra libre o bajo la forma de complejo enzima sustrato. Sin embargo, sabemos que la suma de las dos concentraciones debe igualar la concentración de enzima total (Et). Sustituyéndola en (1)
Si el paso limitante de la reacción fuese la transformación del complejo ES en enzima libre y producto, la velocidad de reacción enzimática será:
La expresión puede ser simplificada si juntamos todas las constantes presentes e el denominador en una nueva constante:
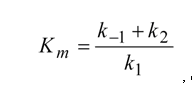 , que es conocida como constante de Michaelis. Cuando
, que es conocida como constante de Michaelis. Cuando 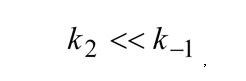 que es también la constante de disociación del complejo ES. Km es por tanto una medida de la estabilidad del complejo enzima-sustrato. Substituyendo en la expresión (2), esta toma así la forma:
que es también la constante de disociación del complejo ES. Km es por tanto una medida de la estabilidad del complejo enzima-sustrato. Substituyendo en la expresión (2), esta toma así la forma:
Cuando
, que es por tanto la velocidad máxima de reacción enzimática. Sustituyendo nuevamente se obtiene la forma familiar de la ecuación de Michaelis-Menten:
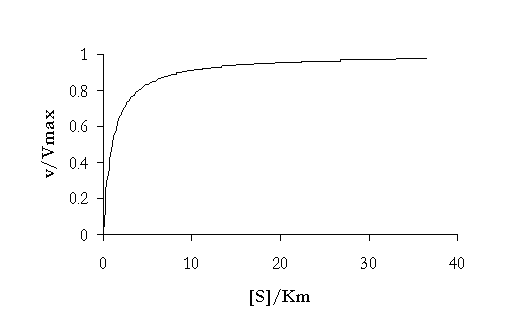
La representación gráfica de la velocidad de reacción en función de la concentración de sustrato es por tanto una hipérbola, que se representa debajo. La asíntota horizontal corresponde a vmax. El valor de Km también puede ser obtenido a través del gráfico, una vez que cuando la [S]=KM , la ecuación de Michaelis-Menten prevé que la velocidad sea
La constante de Michaelis Menten es por tanto la concentración de sustrato para la cual la velocidad de la reacción es la mitad de la velocidad máxima.
El efecto de inhibidores competitivos en la actividad enzimática
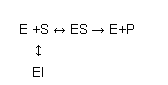 Un inhibidor competitivo de una enzima es una molécula capaz de enlazarse a la enzima e impedir el enlace de la misma al sustrato
Un inhibidor competitivo de una enzima es una molécula capaz de enlazarse a la enzima e impedir el enlace de la misma al sustrato
Para que esto suceda es necesario que el inhibidor se enlace al lugar de la enzima normalmente ocupado por el sustrato (este lugar se denomina “centro activo”), lo que obviamente solo es posible cuando el inhibidor tiene una estructura química bastante semejante a la del sustrato.
Aplicando un tratamiento matemático análogo al utilizado anteriormente, se prueba que en la presencia de un inhibidor competitivo, la velocidad de la reacción enzimática es dada por:
La comparación de esta ecuación con la ecuación de Michaelis-Menten muestra que: en la presencia de un inhibidor competitivo, la velocidad de reacción es inferior a la de la reacción no inhibida (de ahí el nombre de inhibidor).
La concentración de sustrato para la cual la velocidad es mitad de la velocidad máxima
Es:
Este valor (llamémosle KM aparente) es siempre superior al valor de KM en la ausencia del inhibidor.
Cuando 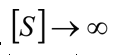 , la velocidad de reacción se aproxima asintoticamente del vmax, tal como en la reacción no inhibida.
, la velocidad de reacción se aproxima asintoticamente del vmax, tal como en la reacción no inhibida.
El efecto de inhibidores no competitivos en la actividad enzimática
Un inhibidor no competitivo de una reacción enzimática a una sustancia que se enlaza a la enzima en un lugar diferente del centro activo y que, mas allá de que no impide el enlace del sustrato al centro activo, impide su transformación en producto: la reacción solo puede ocurrir luego que el sustrato se desenlace de la enzima.
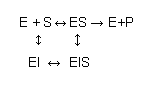 Aplicando un tratamiento matemático análogo al utilizado anteriormente, se prueba que en la presencia de un inhibidor no competitivo, la velocidad de reacción enzimática esta dada por:
Aplicando un tratamiento matemático análogo al utilizado anteriormente, se prueba que en la presencia de un inhibidor no competitivo, la velocidad de reacción enzimática esta dada por:
La comparación de esta ecuación con la ecuación de Michaelis-Menten muestra que: en la presencia de un inhibidor no competitivo, la velocidad de reacción es inferior a la de la reacción no inhibida (de ahí el nombre de inhibidor)
La concentración de sustrato para la cual la velocidad es mitad de la velocidad máxima es igual a la observada en ausencia de inhibidor.
Cuando 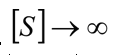 , la velocidad de la reacción se aproxima asintóticamente de
, la velocidad de la reacción se aproxima asintóticamente de 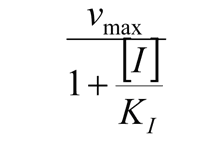 , que es siempre inferior al de la reacción no inhibida.
, que es siempre inferior al de la reacción no inhibida.