Catálisis Heterogénea
La importancia de la catálisis para la industria se debe al hecho del gran número de aplicaciones en la industria química. Las reacciones que ocurren en ese ámbito son, en general, heterogéneas y homogéneas. En la catálisis homogénea el catalizador se ubica en la solución entre los reactivos, como por ejemplo sucede con la destrucción de la capa de ozono.
El proceso catalítico heterogéneo involucra más de una fase, normalmente el catalizador es sólido y los reactivos y productos están en forma líquida o gaseosa.
Catalizadores
Un catalizador cambia la energía de activación presente en una reacción, Ea, porque provee un camino alternativo para ella. La velocidad y la constante de velocidad k de una reacción se relacionan a la Ea por la ecuación de Arrhenius.
k = A exp (- Ea / R T)
Donde A es la constante relacionada a la velocidad de las colisiones. Por tanto un cambio en Ea, altera la velocidad de una reacción.
Propiedad de los Catalizadores
Una reacción catalítica ocurre en la interfase fluido-sólido, una gran área interfacial puede ser útil o mismo esencial en la obtención de una velocidad de reacción significativa. En muchos catalizadores esa área es provista por una estructura porosa; el sólido contiene muchos poros de pequeño diámetro y la superficie de esos poros provee el área necesaria para la alta velocidad de reacción. El área de algunos materiales porosos y sorprendentemente grandes.
Sitio Catalítico
También denominado el sitio activo es muy importante en la catálisis heterogénea. Cuando una reacción se da, estando los reactivos en fase líquida o gaseosa y el catalizador en fase sólida, generalmente no es toda la superficie del sólido que tiene acción efectiva sobre la reacción química: la reacción se desarrolla sobre puntos o regiones específicas del sólido, que son activas (la velocidad de reacción, en casos ideales es directamente proporcional al número de sitos).
Tipos de Catalizadores
Con los recientes avances en el área de la catálisis heterogénea y con la necesidad de procesos cada vez más limpios y de alto rendimiento en la obtención de productos, la complejidad química y física de los catalizadores es cada vez mayor.
La catálisis es esencialmente un fenómeno químico y la capacidad de una sustancia de actuar como un catalizador depende de su naturaleza química.
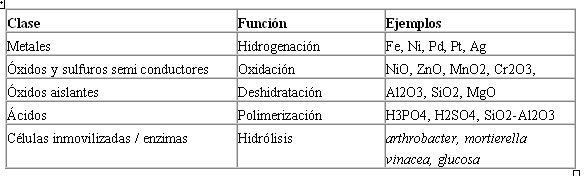
En la Tabla encontramos varios tipos de catalizadores heterogéneos existentes, clasificados conforme a su naturaleza química.
Esta tabla nos muestra que los metales de transición son catalizadores especialmente adecuados para reacciones involucrando hidrógeno e hidrocarburos. Tal adecuación se debe al hecho de que este tipo de sustancias absorben fácilmente superficies metálicas.
Para catálisis de reacciones de oxidación es necesario el uso de metales nobles como el platino, paladio y plata, pues el metal tendrá que ser resistente a oxidación a temperatura de reacción y apenas estos poseen tal resistencia.
Muchos óxidos son también excelentes catalizadores para reacciones de oxidación. Para reacciones de desulfuración es necesario el uso de sulfuros metálicos.
Óxidos como el aluminio, sílice y el óxido de magnesio, son catalizadores muy débiles para reacciones de oxidación debido a su frágil interacción con el oxígeno, pero la facilidad con que absorben agua, lleva a que sean usados en reacciones de deshidratación.
Los ácidos son perfectos catalizadores para reacciones de cracking debido a la facilidad con que rompen enlaces C-C y C-H. Se usa otro tipo de catalizadores que se basan en el uso de enzimas y células inmovilizadas en sustratos de carbono, por ejemplo para la isomerización de la glucosa y la fructuosa.