Ley de Faraday
La Ley de Faraday, también conocida como Ley de inducción electromagnética de Faraday, se encuentra basada en los experimentos que realizó en 1831, el fisicoquímico británico Michael Faraday, sobre el electromagnetismo y la transformación de la energía eléctrica en energía química, o lo que es lo mismo, la electroquímica.
La Ley de Faraday, dice que el voltaje que se le induce a un circuito que se encuentra cerrado, es directamente proporcional a la velocidad con la que cambia el flujo magnético en el tiempo, el cual puede atravesar cualquier superficie, teniendo como límite, o borde al propio circuito.
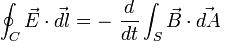
- De donde E, hace referencia al campo eléctrico.
- dl, es el elemento infinitesimal de c ( contorno o borde ).
- B, hace referencia a la densidad de campo magnético
- S, es la superficie.
- dA, viene dada por la ley para determinar las direcciones vectoriales, también conocida como ley de la mano derecha.
Siempre que la superficie a integrar no cambie con respecto al tiempo se puede realizar la permutación de la integral de superficie y la derivada temporal.
A través del teorema de Stokes, se puede conseguir la diferencial de la Ley de Faraday:
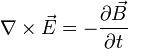
El teorema de Stokes, trata en la geometría diferencial, la integración de las formas diferenciales que se utilizan mucho en la generalización de teoremas en los cálculos vectoriales.
La fórmula anteriormente mencionada, es una de las ecuaciones de Maxwell, la cual forma parte de las ecuaciones fundamentales del electromagnetismo, que junto a otras leyes del electromagnetismo ayudó a unificar al electromagnetismo.
En términos generales, el proceso de deposición de un metal por procedimientos electrolíticos se ciñe a la ecuación:
X^z+ (aq) + Z e → X (s)
Esto significa que, por cada mol de X que se deposita, circularán Z moles de electrones. De este modo, si hacemos circular una carga Q, se depositará una masa (m) del metal. En consecuencia a esto:
Número de moles del metal = m/M → número de moles de electrones = Z.m/M
Así, la carga total que circula será:
Q = Z. m/M.F
Y, si en dicha expresión, despejamos la masa, obtenemos:
m= M/ZF. Q
- De donde m, es la masa del elemento depositado
- Q, es la carga que circular (C)
- M, es la masa molar del elemento
- F, es la constante de Faraday
La carga que es transportada por un mol de electrones, es igual a 1 Faraday, que equivale a 96484,5561 C/mol y es la constante de Faraday, que viene representada con una F, siendo usada en sistemas electroquímicos, para poder calcular la masa de los elementos que forman electrodos. La constante de Faraday procede de la ecuación:
F = N A. q, donde NA, es el número de Avogadro, y q, hace referencia a la magnitud de la carga de un electrón.
La anterior relación, fue descubierta en torno a 1832, recibiendo el nombre de Ley de Faraday.
Michael Faraday, realizó espectaculares aportaciones a la fisicoquímica, pues descubrió la inducción magnética, y ideó la primera dínamo. También, fabricó el primer generador eléctrico, y entre otras cosas, estableció los fundamentos que dieron la posibilidad posteriormente al desarrollo de la teoría electromagnética.
