De que se trata la electroquímica
El objetivo fundamental de la electroquímica es el estudio de sistemas capaces de entregar trabajo útil eléctrico a partir de reacciones de oxireducción (células galvánicas) o de sistemas en los cuales ocurren procesos de oxireducción al recibir trabajo útil eléctrico (electrólisis).
Los primeros estudios electroquímicos datan del año 1786 y fueron realizados por Galvani. El observó que una pata de rana “se movía” cuando a ella se aplicaba una diferencia de potencial eléctrico. Uno de los polos del elemento de descarga eléctrica era fijado al nervio y otro en el músculo. Galvani imaginaba que el sistema formaba un capacitor, descargando su electricidad en la pierna.
Más adelante verificó que el tejido de la pierna permitía el pasaje de electricidad, explicando entonces el fenómeno. En esa época ya eran conocidos los conductores metálicos y por tanto el nuevo conducto fue reconocido como un conductor electrolítico.
En tanto, el mayor descubrimiento de Volta fue la pila voltaica en 1796 formada por plomo y plata inmersos en un electrolito.
Se siguió inmediatamente el descubrimiento de la electrólisis del agua involucrando la liberación de hidrógeno y oxígeno (Nicholson & Carlisle, 1800), la propuesta del mecanismo de salto protónico para conducir electricidad en soluciones ácidas (Grotthuss, 1805) etc.
Finalmente en 1835 surgieron las leyes de Faraday, que continúan siendo válidas hasta hoy, visto su estrecha relación con la estructura funcional de la materia. Fue Faraday quien introdujo términos electroquímicos como ion, catión, anión, electrodo, electrolito, etc. que son utilizadas hasta nuestros días.
Siendo la conducción de electricidad la característica intrínseca de los materiales participantes, es apropiado considerar un sistema electroquímico como compuesto por como mínimo dos conductores electrónicos (llamados electrodos) separados por un conductor electrolítico.
La ley de Faraday
Al pasarse una corriente eléctrica a través de una interface metal/electrolito, ocurren reacciones químicas de oxidación o de reducción en las cuales el metal puede, o no, participar. Por ejemplo, cuando una corriente eléctrica positiva pasa a través de una interface, tal como en el caso de un electrodo de plata metálica inmerso en una solución de una sal de plata soluble, electrones fluyen a través de la interface en sentido inverso al de la corriente y simultáneamente iones plata fluyen en dirección al interior de la solución, ocurriendo la reacción:
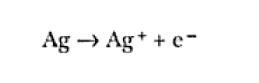
Existen otras posibilidades y uno de los ejemplos más comunes es el caso de un electrodo que no participa de la reacción. Por ejemplo, en platina o carbono inmersos en una solución de iones de hierro:
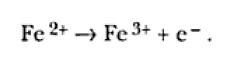
La conclusión de los ejemplos presentados puede ser resumida de la siguiente forma: “El pasaje de una corriente eléctrica de un conductor metálico a un conductor electrolítico, o viceversa, es siempre acompañada por una reacción electroquímica”. Esta es la forma genérica del enunciado de la Ley de Faraday.
Cuantitativamente, Faraday también propuso “La magnitud del efecto químico, en equivalentes químicos, es la misma tanto en la superficie metálica cuanto en la solución electrolítica y esta determinada solamente por la cantidad de electricidad que pasa”. Esto corresponde a decir que, si un equivalente de electrones fluye a través de una interfaz, un equivalente-gramo de la especie involucrada en el proceso electrolítico debería ser oxidado o reducido. La carga corresponde a un equivalente de electrones y tradicionalmente conocida por el nombre del autor de la ley (Faraday) y corresponde matemáticamente a la forma:
F = Ne
Donde F es Faraday, N es el número de Avogadro y e es la carga del electrón. Substituyéndose los valores de N y de e, se obtiene con buena aproximación que F = 96.500 C.
Por tanto, en una electrólisis en la cual la corriente es mantenida constante, la masa de material involucrada n cada uno de los procesos electrolíticos puede ser calculada por la reacción:
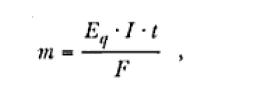
Donde I es la corriente, t es el tiempo y Eq es el equivalente-gramo de la especie involucrada en el proceso electrolítico, o sea;
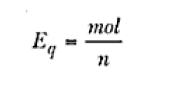
Siendo n el número de electrones que están involucrados en la reacción electroquímica.
