Hiperconjugación
Cuando un enlace entre un átomo de carbono y uno de hidrógeno (H-C) se encuentra adyacente a un sistema conjugado, por ejemplo un doble enlace o un anillo bencénico, los electrones sigma del enlace H-C pasan a formar parte de este sistema conjugado, es decir, se deslocalizan de la misma manera que los electrones pi que forman este sistema. A este fenómeno se le llama hiperconjugación.
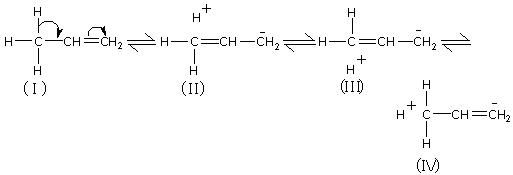
El concepto de hiperconjugación fue descrito por Baker y Nathan, y es conocido también como efecto Baker y Nathan. De acuerdo con este concepto, si un grupo alquilo (que esté unido al menos con un átomo de hidrógeno), es enlazado a un átomo de carbono que esté formando parte de un doble enlace, el grupo alquilo cederá electrones de su enlace simple H-C hacia el enlace múltiple. Por ejemplo, la hiperconjugación del propeno es la que se observa en la siguiente figura:
Las distintas formas de hiperconjugación del propeno se denominan estructuras contribuyentes. El fenómeno de hiperconjugación tiene algunos puntos de similitud con el efecto de resonancia. En la hiperconjugación, no existe enlace entre en carbono a y el átomo de hidrógeno que cede electrones, de esta manera este fenómeno es también llamado “resonancia sin enlace”.
Dado que la hiperconjugación depende de átomos de hidrógeno unidos a un carbono, un grupo CH3– tiene más probabilidad de participar en este tipo de efecto que un grupo CH3CH2. Asimismo, éste último tiene mayor posibilidad de hiperconjugación que un grupo (CH3)2CH-. Si un grupo (CH3)3C- se une a un sistema conjugado, no habrá hiperconjugación.
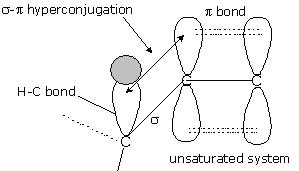
Desde el punto de vista de los orbitales moleculares, podemos decir que los electrones del enlace C-H, que es un enlace sigma, de deslocalizan y pasan a formar parte del sistema conjugado formado por los orbitales pi del doble enlace, como se puede observan en la figura de abajo.
El concepto de hiperconjugación explica algunas características especiales en moléculas orgánicas:
- El enlace simple carbono-carbono adyacente al doble enlace es más corto. Por ejemplo, en el metilacetileno, el enlace simple C-C es de 1.46 angstrom, bastante menor que la longitud habitual del enlace C-C, de 1.54 angstrom.
- Incremento en el momento dipolar. El marcado aumento en el momento dipolar del tricloroetano, en comparación con el cloroformo, se debe a efectos de hiperconjugación.
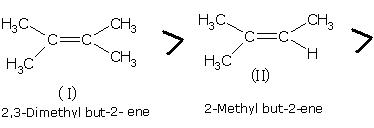
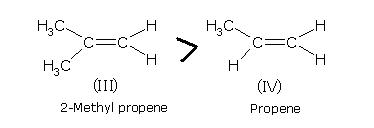
- Estabilidad de alquenos metilados. Cuando es mayor el número de grupos metilo unidos al enlace doble de un alqueno, mayor es su estabilidad. Esto se debe a que hay mayor cantidad de átomos de hidrógeno que participan en el efecto de hiperconjugación.
De esta manera, la estabilidad del 2,3 dimetil-2 buteno es mayor que la del 2- metil -2 buteno, como se ve en la siguiente figura:
El fenómeno de hiperconjugación también puede explicar la relativa estabilidad de carbocationes y radicales libres.