Cinética enzimática
La cinética enzimática es la disciplina que estudia la velocidad en las reacciones químicas en las que intervienen enzimas. El estudio de esta velocidad y de la dinámica de la enzima, nos permite conocer a fondo el mecanismo de acción de dicha enzima, el rol que cumple en el metabolismo, y la regulación de su actividad por inhibidores naturales, fármacos, venenos u otro tipo de sustancias.
Las enzimas son proteínas que son capaces de manipular a otras macromoléculas, llamadas sustratos. Un sustrato es capaz de unirse al sitio activo de una enzima, es decir, se une a una determinada zona de la enzima, diseñada especialmente para unirse a un sustrato. Una vez que esta unión se ha dado, se produce la catálisis, es decir, la obtención de productos a partir del sustrato, gracias a la acción enzimática.
Algunas enzimas son capaces de unirse a distintos sustratos y obtener a partir de ellos, distintos productos, por ejemplo una proteasa puede actuar sobre distintas proteínas para obtener una variedad de polipéptidos. En algunos casos, la enzima es capaz de unirse a dos sustratos a la vez, como por ejemplo la ADN polimerasa, que se une a la hebra de ADN y a un nucleótido, para agregarlo a la cadena.
La velocidad de la reacción catalizada enzimáticamente, es directamente proporcional a la concentración de sustrato, hasta cierto punto. Como se ve en el dibujo de abajo, cuando la concentración del sustrato es baja, una parte de las moléculas enzimáticas tienen su sitio activo libre. Si aumentamos la cantidad de sustrato, estos sitios activos libres se unirán a él, acelerando la velocidad de la reacción sustratoà productos. Si continuamos aumentado la cantidad de sustrato, llegará un momento en donde ya no habrá más sitios activos libres, entonces la velocidad de la reacción ya no puede aumentar más. Cuando se llega a este punto se dice que la enzima está saturada.
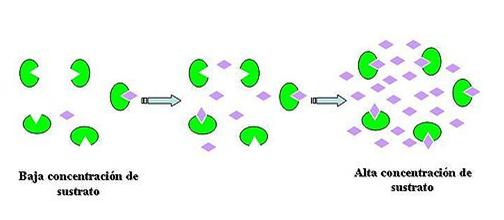
En la cinética enzimática, las dos propiedades de mayor importancia son: el tiempo que tarda una enzima en llegar a su punto de saturación y la velocidad máxima que puede alcanzar la reacción catalizada por dicha enzima.
La velocidad de una reacción enzimática puede ser medida en el laboratorio. Como la enzima no se consume en el proceso de catálisis de la reacción, se suele medir la disminución de la concentración de sustrato en el tiempo, o el aumento de concentración del producto. Estas concentraciones se pueden medir por espectrofotometría o radiometría.
Si tenemos una enzima de sustrato único, podríamos representar la reacción catalizada por la enzima mediante el siguiente esquema:
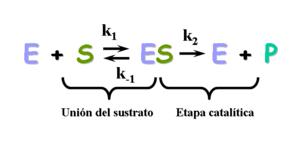
Como vemos, en un principio tenemos enzima y sustrato separados. Luego pasa a formarse un complejo enzima-sustrato cuando éste último se une al sitio activo de la enzima. Por último, la enzima libera el producto de la reacción. K1, K-1 y K2 son las constantes cinéticas de la reacción.
La velocidad de esta reacción, puede ser representada por la siguiente fórmula:
![]()
Donde k2 también llamada número de recambio, representa el número máximo de reacciones catalizadas, por segundo.
Además de las propiedades mencionadas, es importante considerar otros factores que afectan la cinética enzimática. La temperatura y el pH son dos variables críticas. Cada enzima tiene una temperatura y un pH óptimos en los cuales su actividad es máxima. Fuera de estos rangos, la estructura de la enzima puede alterarse, disminuyendo su eficacia o incluso desnaturalizándose completamente.
Otro aspecto relevante es la presencia de inhibidores y activadores. Los inhibidores pueden ser competitivos, no competitivos o acompetitivos. Los inhibidores competitivos se unen al sitio activo de la enzima, compitiendo directamente con el sustrato. Los inhibidores no competitivos se unen a otra parte de la enzima, cambiando su forma y reduciendo su actividad. Los inhibidores acompetitivos se unen al complejo enzima-sustrato, impidiendo la formación del producto.
Por otro lado, los activadores son moléculas que aumentan la actividad enzimática. Pueden actuar de diferentes maneras, como facilitando la unión del sustrato al sitio activo o estabilizando la estructura de la enzima.
En el ámbito biotecnológico, la cinética enzimática tiene aplicaciones prácticas significativas. Por ejemplo, en la industria farmacéutica, se utilizan enzimas para la síntesis de medicamentos. En la industria alimentaria, las enzimas juegan un papel crucial en procesos como la fermentación y la producción de productos lácteos. Además, en la investigación biomédica, el estudio de la cinética enzimática es fundamental para el desarrollo de nuevas terapias y diagnósticos.
Finalmente, es importante mencionar que la modelización matemática de la cinética enzimática, como la ecuación de Michaelis-Menten, es una herramienta poderosa para predecir el comportamiento de las enzimas bajo diferentes condiciones. Esta ecuación describe cómo la velocidad de reacción depende de la concentración de sustrato y de dos parámetros específicos: la constante de Michaelis (Km) y la velocidad máxima (Vmax).
En resumen, la cinética enzimática es una disciplina compleja y multifacética que abarca desde la biología molecular hasta la ingeniería química, ofreciendo valiosas perspectivas y aplicaciones en diversos campos científicos y tecnológicos.
