Tensión angular
En la naturaleza, los cicloalcanos de dos o tres carbonos son muy poco comunes. Los cicloalcanos más habituales están compuestos por cinco o seis carbonos unidos en forma de anillo. Esto se debe a que el enlace simple entre carbonos, de orbitales sp3, tiene un ángulo de enlace natural de 109,5º. Con este ángulo la distancia entre los átomos es máxima.
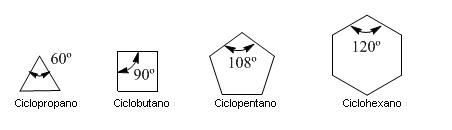
Dada las limitaciones de las estructuras cíclicas, en cicloalcanos tales como ciclopropano y ciclobutano, el ángulo de enlace se reduce mucho, por lo tanto, se desarrolla la denominada tensión angular, y la molécula es inestable.
Las moléculas no cíclicas por lo general no desarrollan tensión angular, porque los enlaces tienden a girarse hasta llegar al estado de menor energía, es decir, hasta lograr la mayor estabilidad posible.
En el año 1885, el químico alemán Adolf von Baeyer fue el que supuso que la inestabilidad de los cicloalcanos con tres o cuatro carbonos se debía a la tensión en los ángulos de enlace.
Von Baeyer supuso que el cicloalcano más estable sería el ciclopentano, porque el ángulo de enlace en este anillo es de 108 grados, el que más se acerca al ángulo ideal de 109,5 grados.
Sin embargo, está demostrado experimentalmente que el cicloalcano con menor energía, o sea con mayor estabilidad, es el ciclohexano. Esto se debe a que estos compuestos cíclicos no son planos, y a que existen otros factores que intervienen en la estabilidad de este tipo de enlace.
La tensión torsional se combina con la tensión angular, para formar la tensión anular, que afecta a las moléculas cíclicas. La tensión de torsión es la desarrollada cuando un átomo o grupo de átomos se encuentran cercanos y sufren fuerzas de repulsión.
Para disminuir a su mínima expresión la tensión angular y la tensión de torsión, las moléculas de cicloalcanos tienden a ubicar los átomos de hidrógeno unidos a sus carbonos, lo más alejados que se pueda, y a plegarse en el espacio, alcanzando así la máxima estabilidad posible.
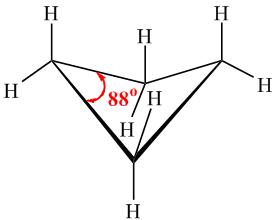
En la figura que sigue observamos una representación de la disposición tridimensional de los átomos que componen al ciclobutano. Se observa que un grupo CH2 forma un ángulo de 25 grados con el plano en el que se encuentran los otros tres carbonos.
De esta manera se libera algo de tensión torsional, al alejarse los átomos de hidrógeno unidos al carbono que se pliega, pero persiste la tensión angular.
La forma más estable del ciclohexano es ligeramente flexionado, de una manera que se denomina “silla”.

Con esta conformación tridimensional, se elimina la tensión angular, ya que el ángulo de enlace es cercano al ideal, y además se minimiza la tensión torsional, ya que los hidrógenos se disponen de tal manera que las fuerzas de repulsión entre ellos son mínimas. De esta manera, el ciclohexano alcanza una gran estabilidad, siendo uno de los cicloalcanos más frecuentes en la naturaleza.
