Molecularidad
Molecularidad en química es el número de entidades moleculares colisionando que están involucradas en una única etapa de reacción.
En cuanto al orden de una reacción es derivado experimentalmente, la molecularidad es un concepto teórico y puede ser solamente aplicando las reacciones elementales. En reacciones elementales, el orden de reacción, la molecularidad y los coeficientes estequiométricos son el mismo, más allá que solo numéricamente, porque ellos son conceptos diferentes.
- Una reacción involucrando una entidad molecular es llamada unimolecular.
- Una reacción involucrando dos entidades moleculares es llamada bimolecular.
- Una reacción involucrando tres entidades moleculares es llamada termolecular.
Termoleculares en soluciones o mezcla de gases son muy raras, por causa de la improbabilidad de que tres entidades moleculares colisiones simultáneamente.
Más allá que el término termolecular sea también usado para referirse a reacciones de asociación de tres cuerpos del tipo:
Donde el M sobre la seta denota que para conservarse energía y momento una segunda reacción con un tercer cuerpo es requerido. Luego de la colisión bimolecular inicial de A y B una reacción intermediaria energéticamente excitada es formada, entonces, colisionan con un cuerpo M, en una segunda reacción bimolecular, transfiriendo la energía excedente para el.
La reacción puede ser explicada como dos reacciones consecutivas:
Estas reacciones frecuentemente tienen una región de transición dependiente de temperatura y presión con cinética entre segundo y tercer orden.
Algunas reacciones ocurren en un único paso. La reacción en que un átomo de cloro es transferido del ClNO2 para el NO para formar NO2 y CLNO es un buen ejemplo de reacción en un único paso.
ClNO2(g) + NO(g) NO2(g) + ClNO(g)
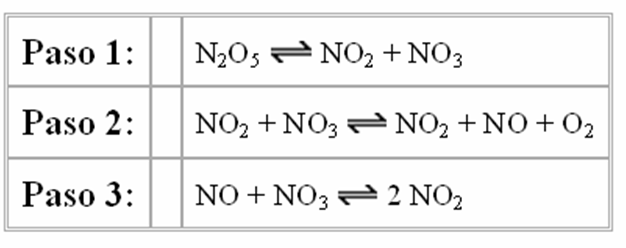
Otras reacciones ocurren en una serie de pasos individuales. N2O5, por ejemplo, se descompone en NO2 y O2 por un mecanismo de tres pasos.
Paso 1: N2O5 NO2 + NO3
Paso 2: NO2 + NO3 NO2 + NO + O2
Paso 3: NO + NO3 2 NO2
Los pasos de una reacción son clasificados en términos de molecularidad, que describe el número de moléculas consumidas. Cuando una única molécula es consumida, el paso es llamado como unimolecular. Cuando dos moléculas son consumidas, el paso es bimolecular.
Probemos determinar la molecularidad de cada paso en la reacción por la cual el N2O5 se descompone en NO2 y O2.
Todo lo que tenemos que hacer es contar el número de moléculas consumidas en cada paso de esta reacción para decidir que el primer paso es unimolecular y que los otros dos pasos son bimoleculares:
Las reacciones también pueden ser clasificadas en términos de su orden. La descomposición de N2O5 es una reacción de primer orden porque la tasa de reacción depende de la concentración de N2O5 elevada a la primera potencia
Tasa = k.[N2O5]
La descomposición del Hl es una reacción de segundo orden porque la tasa de reacción depende de la concentración del Hl elevada a la segunda potencia.
Tasa = k.[HI]2
Cuando la tasa de reacción depende de más de un reactivo, clasificamos la reacción en términos del orden de cada reactivo.
Ahora vamos a clasificar el orden de reacción entre el NO y el O2 para formar NO2:
2 NO(g) + O2(g) 2 NO2(g)
Supongamos la siguiente ley de velocidad para esta reacción:
Tasa = k.[NO]2[O2]
Esta es una reacción de primer orden en O2, segundo orden en NO y tercer orden global.
La diferencia entre molecularidad y orden de una reacción es importante. La molecularidad de una reacción, o paso dentro de una reacción, describe lo que sucede a nivel molecular. El orden de reacción describe lo que sucede en escala macroscópica.
Determinamos el orden de la reacción observando si los productos de una reacción aparecen o los reactivos desaparecen. La molecularidad de la reacción es algo que deducimos para explicar estos resultados experimentales.