Efecto pantalla
En física atómica, se le llama efecto pantalla al efecto que causan los electrones que se hallan más cerca del núcleo sobre los que están en niveles más externos. Los electrones que se encuentran en niveles bajos, disminuyen la fuerza de atracción que ejerce en núcleo, cargado positivamente, sobre los electrones que se encuentran más alejados del mismo. Además, los electrones de distintos niveles sufren fuerzas de repulsión, debido a que sus cargas negativas se repelen.
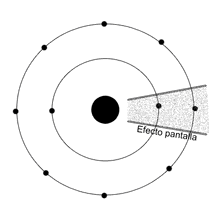
Desde el punto de vista de la física cuántica, se podría definir el efecto pantalla como la interferencia hallada entre la órbita más externa de un átomo y su núcleo.
Los orbitales atómicos s son los que más efecto pantalla (representado con la letra S del inglés Shielding o Screening) causan, seguidos de los orbitales p, d y f en ese orden.
S(s) > S(p) > S(d) > S(f)
En los átomos de los elementos de los últimos períodos de la tabla periódica, el efecto pantalla es más marcado, debido a que tienen mayor cantidad de electrones en niveles externos, apantallados por los electrones de los niveles inferiores.
Además, algunas teorías relativistas afirman que en estos átomos se produce contracción de orbitales s y p, acentuando aún más el efecto pantalla.
Un ejemplo de este fenómeno es el de contracción del orbital 6s hacia el núcleo, causando la penetración de orbitales d y f en niveles inferiores, es por eso que el efecto pantalla de éstos orbitales sobre electrones más externos es mayor en elementos del sexto período que en los del cuarto período de la tabla.
El efecto pantalla está íntimamente ligado a la carga nuclear efectiva, como se puede observar en la siguiente expresión:
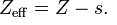
Z eff representa la carga nuclear efectiva, Z la carga nuclear real (número atómico del elemento) y s o S o σ, la constante del efecto pantalla.
Una forma de dejar en evidencia este efecto, es medir la energía que se necesita para quitar los electrones de un átomo. Tomemos por ejemplo el átomo de Helio, que tiene dos electrones, completando el orbital atómico 1s2.
Para quitar el primer electrón, se necesitan 2373 kJ por mol, mientras que para quitar el segundo se necesitarán 5251 kJ por mol. Esto de debe a que cuando están los dos electrones, el efecto de pantalla hace que la fuerza que los atrae hacia el núcleo sea menor, en cambio, cuando hay sólo un electrón, el efecto pantalla no existe, entonces es atraído con mayor fuerza por las cargas positivas del núcleo (los protones).
